На обогатительной фабрике из 20 т медной сульфидной руды, содержащей 0.015 массовых долей Сu, получено 2 т концентрата, в котором обнаружено 14.4 и СuS (по массе). Определите выход концентрат, степень извлечения и степень концентрации меди.
Решение.
Определяем выход концентрата:
ηк = (2/20) · 100 = 10%.
Определяем массу меди в руде:
(20 · 1.5)/100 = 0.3 т.
Масса сульфида меди в концентрате составит:
(2 · 14.4)/100 = 0.288 т,
а масса меди:
(0.288 · 64)/96 = 0.192 т.
Степень извлечения:
ε = (0.192/0.03) · 100 = 64%.
Массовая доля меди в концентрате:
ωк = (0.192 · 100)/2 = 9.6%.
Степень концентрации:
α = 9.6/1.5 = 6.4.
Одним из основных показателей качества воды является ее жесткость, которая в соответствии со стандартами выражается в ммоль/дм3. Обычно общая жесткость воды (Жо) определяется суммой карбонатной (Жк) и некарбонатной (Жн) жесткости:
Жо = Жк + Жн.
Если молярная концентрация ионов
 < концентрации смеси ионов (
< концентрации смеси ионов (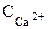 +
+ 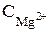 ), то Жк =
), то Жк =  .
.
При  >
> 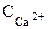 +
+ 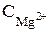 , Жк =
, Жк = 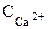 +
+ 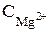 .
.
Карбонатную жесткость можно определить титрованием пробы исследуемой воды раствором соляной кислоты. В этом случае расчет удобно вести по формуле:
Жк = V · СНСl · 1000/2 ·  , (5.1)
, (5.1)
где V – объем раствора соляной кислоты, см3, СНСl – молярная концентрация соляной кислоты, моль/дм3;  – объем воды, взятой для анализа.
– объем воды, взятой для анализа.
Окисляемость воды (Ов) характеризует содержание в ней органических веществ и выражается массой кислорода (мг), израсходованного на окисление органических примесей в 1 дм3 воды при кипячении ее с перманганатом калия. Для вычисления значения Ов исследуемой воды можно использовать формулу:
Ов = V ·  · 158 · 0.253 · 1000 /
· 158 · 0.253 · 1000 /  , (5.2)
, (5.2)
где V – объем раствора см3 перманганата калия, прилитого к определенному объему воды ( );
);  – молярная концентрация перманганата калия, моль/дм3; 158 – относительная молекулярная масса перманганата калия; 0.253 – коэффициент пересчета окисляемости воды в мг/см3 кислорода.
– молярная концентрация перманганата калия, моль/дм3; 158 – относительная молекулярная масса перманганата калия; 0.253 – коэффициент пересчета окисляемости воды в мг/см3 кислорода.
Из способов умягчения воды наиболее распространены химические (реагентные) и физико-химические. Среди реагентных способов большое значение имеет фосфатный и известково-содовый. Расчеты по ним сводятся к обычным стехиометрическим вычислениям, причем, по последнему, нахождение дозы извести удобно вести по формуле:
Ди = (Мт/2) · [  /22.1 +
/22.1 +  /61.2 +
/61.2 + 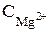 /12.16 + Дк/К + 0.5]·100/ω (5.3)
/12.16 + Дк/К + 0.5]·100/ω (5.3)
где Ди – доза извести (для устранения карбонатной жесткости) в персчете на СаО, мг/дм3; Дк – доза коагулянта в пересчете на безводное вещество, мг/дм3; С – массовая концентрация ионов в умягчаемой воде, мг/дм3; К – коэффициент пересчета концентрации коагулянта, равный для FеСl3 54, для FеSО4 76; ω – массовая доля СаО в применяемой извести, %; Мт – относительная молекулярная масса СаО.
Широкое применение имеет ионообменный метод умягчения воды. В этом случае расчеты обычно связаны с нахождением емкости поглощения (Еп) ионита, под которой понимают количество ионов, задержанное 1м3 или 1 кг ионита. Емкость поглощения выражается в моль/м3 или моль/кг.






