У ЛАБОРАТОРНА ДІАГНОСТИКА ХВОРОБ, СПРИЧИНЕНИХ КИШКОВИМИ БАКТЕРІЯМИ
Мета заняття:
— знати особливості взяття патологічного матеріалу для дослідження та його транспортування до бактеріологічної лабораторії;
— навчитися проводити взяття патологічного матеріалу для дослідження;
— навчитися оформляти супровідну документацію;
— навчитися проводити первинний посів матеріалу на поживні середовища;
— знати препарати для специфічного лікування та профілактики хвороб, спричинених кишковими бактеріями.
Оснащення: поживні середовища виготовлені та з ростом культури ешерихій і сальмонел, поживні середовища Ендо, Плоскирєва, вісмут-сульфіт агар, Ресселя, Гісса, МПБ з інді-каторними папірцями, фантом, ректальний тампон, ізотонічний розчин натрію хлориду у флаконі, бланки направлення, стерильна баночка з дерев'яною паличкою (для демонстрації), стерильні баночки з розведеними фекаліями у відношенні 1:10, бактеріологічні петлі, шпателі для посіву, пінцети, маркер, сірники, спиртівки, вакцини, лікувальні препарти.
План
1. Взяття фекалій для дослідження, оформлення направлення.
2. Посів калу на середовища Ендо, Плоскирєва, вісмут-сульфіт агар.
3. Вивчення росту ешерихій, сальмонел, шигел на середовищах Ендо, Плоскирєва, Ресселя, Гісса, вісмут-сульфіт агарі.
4. Ознайомлення з методикою проведення серологічного методу діагностики.
5. Ознайомлення з препаратами для специфічної профілактики і лікування хвороб, спричинених кишковими бактеріями.
Хід заняття
1. Взяття фекалій для дослідження, оформлення направлення
Завдання 1. Ознайомтеся з методами взяття фекалій на бактеріологічне дослідження.
Оскільки ентеробактерії (ешерихії, шигели, сальмонели) уражують переважно кишечник, на аналіз найчастіше відбирають фекалії. Відбір проводять двома способами: фекалії відбирають із суден, горшків чи лотків у стерильну баночку або забирають ректальним тампоном.
Оптимальний для виділення культури ентеробактерій відбір фекалії слід провести одразу після дефекації. Посуд, у який збирають фекалії від хворого, дезінфікують освітленим розчином хлорного вапна, потім багаторазово промивають гарячою водою до повного видалення слідів дезінфектанту. Фекалії відбирають із посуду (у немовлят — із пелюшок) стерильною дерев'яною паличкою у кількості 3—5 г із останніх порцій (більшість ентеробактерій уражує тонку кишку) і вміщують у стерильну баночку. Якщо у фекаліях є домішки, то їх обов'язково включають у пробу: гній, слиз, пластівці (але не кров!). У разі неможливості отримати фекалії після дефекації матеріал відбирають безпосередньо із прямої кишки ректальним тампоном.
Завдання 2. Проведіть (на фантомі) відбір фекалій ректальним (від лат. rectum — пряма кишка) тампоном.
Алгоритм "Взяття фекалій ректальним тампоном":
— надягніть гумові рукавички;
— покладіть фантом на лівий бік (пацієнту пропонують лягти на лівий бік і зігнути ноги в колінах);
— візьміть ректальний тампон (без пробірки) у праву руку;
— візьміть у ліву руку флакон зі стерильним ізотонічним розчином натрію хлориду, зніміть з нього пробку мізинцем правої руки;
— опустіть ректальний тампон у флакон з ізотонічним розчином натрію хлориду;
— видаліть ректальний тампон з флакона, віджимаючи його об стінки флакона;
— закрийте флакон пробкою (тампон тримайте правою ру-
кою);
Увага! Не можна відбирати матеріал сухим тампоном. Не можна вводити тампон силою. За наявності набряку слизової оболонки прямої кишки і виразок це призведе до додаткового травмування і спричинить біль у пацієнта.
— розведіть сідниці пацієнта великим і вказівним пальцями лівої руки;
— уведіть тампон у пряму кишку на 3—5 см у напрямку пупка, поверніть його паралельно до хребта і введіть ще на 5—7 см;
Увага! У дорослих тампон вводять на глибину 8—10 см, у дітей — на 3—5 см.
— видаліть тампон із прямої кишки, опустіть його у стерильну пробірку (з якої був взятий), підпишіть на пробірці номер аналізу;
— поставте тампон у штатив, вимийте руки;
— заповніть направлення.
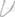
2. Посів калу на поживні середовища Ендо, Плоскирєва, вісмут-сульфіт агар
Завдання 3. Проведіть лосів фекалій на середовища Ендо, Плоскирєва, вісмут-сульфіт агар.
Фекалії, відібрані у стерильні баночки, мають бути посіяні не пізніше 2 год від моменту взяття.
Доставлені фекалії розводять ізотонічним розчином натрію хлориду у співвідношенні 1:5 або 1:10 і дають відстоятися протягом ЗО—60 хв. Грубі часточки фекалій осідають на дно. Енте-робактерії як факультативні аероби скупчуються на поверхні, тому під час посіву матеріал відбирають з баночки бактеріологічною петлею або піпеткою з поверхні і наносять 1—2 краплі на поверхню поживного середовища. Поверхня пластинчастих середовищ повинна бути підсушеною, на ній не має бути крапель конденсаційної води.
Посів проводять петлею або шпателем.
Методику посіву на пластинчасте середовище петлею див. у практичному занятті 3, завдання 2; методику посіву шпателем див. у практичному занятті 3, завдання 7.
Чашки з посівами ставлять у термостат за температури 37 °С.
3. Вивчення росту ешерихій, сальмонел, шигел на середовищах Ендо, Плоскирєва, вісмут-сульфіт агарі,
Ресселя, Гісса
Завдання 4. Опишіть культуральні властивості ентеро-бактерій на середовищах Ендо, Плоскирєва, вісмут-сульфіт агарі, Ресселя, Гісса, (алгоритм див. у практичному занятті 3, завданнях 9,10,11).
Порівняйте стерильне середовище Ресселя із посівом культури ентеробактерій, зробіть висновок, орієнтовно до якого роду можна віднести культуру: ешерихій, сальмонел чи шигел.
Оскільки ешерихії ферментують лактозу і глюкозу, у середовищі змінюється колір індикатора в косячку і в стовпчику. Сальмонели і шигели ферментують тільки глюкозу, тому колір індикатора змінюється тільки в стовпчику. Наявність газу визначають за наявністю кульок газу або розриву середовища.
Невелика кількість ознак, що виявляються у культури ентеробактерій на середовищі Ресселя, не дає змоги достовірно визначити її родову приналежність, тому з метою диференціації родів використовують середовища Гісса і МБП.
Порівнюючи контрольні й дослідні ряди середовищ Гісса і враховуючи колір індикаторних папірців, роблять висновок про сахаролітичні і протеолітичні властивості ентеробактерій. На середовищах Гісса визначають також рухливість мікроорганізмів. Якщо культура росте вздовж уколу, а середовище залишається прозорим, мікроби нерухливі, якщо культура росте по всьому об'єму середовища, то мікроби рухливі.
Найточніше визначають рід виділеної культури за антигенною структурою в РА на склі з імунними сироватками.
І 4. Ознайомлення з методикою проведення серологічного методу діагностики
Завдання 5. Ознайомтеся з проведенням серологічного методу діагностики при захворюваннях сальмонельозної етіології.
Для серологічної діагностики черевного тифу, паратифів А і В та інших сальмонельозів використовують реакцію Відаля.
Антитіла у хворих на черевний тиф і паратифи А і В з'являються у крові уже на 4-у добу хвороби, і їх кількість різко збільшується на 8—10-у добу.
Оскільки клінічно черевний тиф і паратифи А і В дуже схожі, серологічні реакції, в тому числі і реакцію Відаля, ставлять одночасно з діагностикумами S. typhi (O- і Н-) і S. paratyphi А і В (ОН-). Збудником хвороби вважають той мікроорганізм, діа-гностикум з якого дає позитивну реакцію аглютинації з сироваткою крові хворого. Збудники черевного тифу і паратифів А і В мають спільні групові антигени, тому їх діагностикуми здатні давати групову РА. Позитивним вважається результат у тому ряду пробірок, де аглютинація відбувається у більшому розведенні сироватки.
Щоб відрізнити РА у хворого від щеплювальної або анамнестичної, реакцію Відаля ставлять повторно через 5—7 діб. У хворого титр антитіл зростає, а у щепленого або перехворілого не змінюється. Не змінюється також і результат групової реакції (табл. 5).
У період реконвалесценції титр антитіл зменшується, що також є діагностичною ознакою.

При інших сальмонельозах реакція Відаля може бути використана для ретроспективної (від лат. retro — назад) діагностики, тобто діагностики після одужання. Однак необхідно враховувати індивідуальні відхилення від нормального циклу імуногенезу. В ослабленому організмі зі зниженою реактивністю, а також у дітей 1-го року життя антитіла накопичуються повільно.
Після проведення обліку РА може бути 2 варіанти відповіді: 1) негативна РА — реакція з діагностикумом... негативна; 2) позитивна РА — реакція з діагностикумом... позитивна до титру...
Крім О- і Н-антигену S. typhi містять Vi-антиген. Оскільки ці форми S. typhi більш стійкі до захисних механізмів макроорганізму, вони здатні спричинити хронічне бактеріоносійство. При цьому у крові носія накопичуються Vi-антитіла. Отже, виявлення Vi-антитіл у крові є прямим доказом носійства збудників черевного тифу. Для виявлення Vi-антитіл найбільш чутливою є реакція Vi-гемаглютинації.
Для встановлення більш обґрунтованого діагнозу проводять визначення антитіл, що належать до певного класу імуногло-булінів — IgM і IgG. Анамнестичні і щеплювальні належать в основному до класу IgM.
У разі вираясеного гострого і особливо хронічного бактеріо-носійства зростає титр IgG.
5. Ознайомлення з препаратами для специфічної профілактики і лікування хвороб, спричинених кишковими бактеріями
Завдання 6. Ознайомтеся з інструкціями щодо застосування препаратів для специфічної профілактики і лікування хвороб, спричинених кишковими бактеріями, визначте їх придатність до використання.
Контрольні запитання
1. Які поживні середовища використовують для первинного посіву матеріалу з метою виділення ентеробактерій?
2. Які існують методи відбору фекалій при хворобах, спричинених ентеробактеріями?
3. Як проводять відбір матеріалу після дефекації? Як його готують до посіву?
4. Як проводять відбір матеріалу ректальним тампоном?
5. Як проводять первинний посів відібраного матеріалу?
6. За якими ознаками проводять первинну ідентифікацію ентеробактерій?
7. Які середовища використовують для вивчення ферментативної активності ентеробактерій?
8. Які визначення слід провести для остаточної ідентифікації культури?
9. Які серологічні реакції використовують для діагностики сальмонельозу? Як відрізнити реакцію аглютинації у хворого від щеплювальної або анамнестичної?
10. Яку серологічну реакцію використовують для виявлення хронічних носіїв інфекції?
Тести
Ешерихії, що спричинюють дезинтерієподібну форму хвороби:
а) ЕПЕК;
б) ЕІЕК;
в) ЕТЕК;
г) ЕГЕК.
Патогенні ешерихії здатні спричинити інфекції:
а) тільки ендогенні;
б) тільки екзогенні;
в) ендогенні й екзогенні.
Коліентерити у дітей раннього віку спричинюють:
а) ЕПЕК;
б) ЕІЕК;
в) ЕТЕК;
г) ЕГЕК.
Товсту кишку уражають:
а) ЕПЕК;
б) сальмонели;
в) ЕТЕК;
г) шигели.
На бактеріологічне дослідження відбирають:
а) кал, гній і слиз;
б) кал, кров і слиз;
в) кал, гній і кров;
г) кал без домішок.
Середовища для виділення ентеробактерій під час первинного посіву:
а) ЖСА і кров'яний агар;
б) Ендо і Плоскирєва;
в) Плоскирєва і сироватковий агар;
г) Сабуро і тіогліколеве.
7. Для серологічної діагностики черевного тифу використовують реакції:
а) Вассермана;

б) Вейля—Фелікса;
в) Відаля;
г) Райта.
8. Для виявлення хронічних носіїв збудників черевного тифу
найефективнішими є:
а) виявлення збудника у випорожненнях;
б) виявлення 0- і Уі-антитіл у сироватці крові;
в) виявлення збудника у крові;
г) виявлення О- і Н-антитіл у сироватці крові.
9. Для профілактики внутрішньолікарняних інфекцій, спри-
чинених ентеробактеріями, використовують:
а) піобактеріофаг;
б) колі-протейний фаг;
в) еубютики;
г) антибіотики.
Ситуаційні задачі
1. Після посіву випорожнень на середовища Ендо і Плоскирєва виросли яскраво забарвлені і безбарвні колонії. Які колонії дають підставу запідозрити наявність патогенних ентеро-бактерій у досліджуваному матеріалі?
2. Випорожнення хворого на дизентерію залили 3 % розчином хлораміну і витримали 3 год. Чи достатньо цього для знезараження матеріалу?
3. Хвороба проявляється нудотою, блюванням, частими випорожненнями, які спочатку виділяються у великій кількості, можуть мати вигляд м'ясних помиїв або мутного слизу і крові — "ректальний плювок". Які мікроорганізми могли спричинити такі клінічні ознаки? Як підтвердити діагноз?
4. Для діагностики черевного тифу поставили реакцію аглютинації з черевнотифозним О- і Н-діагностикумом. Титр сироватки з О-діагностикумом— 1:50, з Н-діагностикумом — 1:200. Який висновок можна зррбити, виходячи з цих результатів?
5. Проводячи облік реакції Відаля, виявили, що О-антитіла виявляються у титрі 1:800, Н-антитіла — 1:200. Про який період хвороби це свідчить?
6. Під час профілактичного обстеження на черевний тиф у сироватці крові виявили 0-, Н- і Уі-антитіла. Про що свідчать результати цього дослідження?
Домашнє завдання
Підготуйтесь до практичного заняття 10.
Рекомендації щодо самопідготовки до практичного заняття 10
1. Ознайомтеся з темою і метою практичного заняття, запишіть у щоденнику тему і план заняття.
2. Вивчіть теоретичний матеріал (див. підручник, с. 251— 277; практикум, с. 114—122).
Практичне заняття 10
ЛАБОРАТОРНА ДІАГНОСТИКА ХВОРОБ, СПРИЧИНЕНИХ ЗБУДНИКАМИ ОСОБЛИВО НЕБЕЗПЕЧНИХ ІНФЕКЦІЙ
Мета заняття:
\^г- знати особливості забору патологічного матеріалу для дослідження та його транспортування до бактеріологічної лабораторії;
-— уміти проводити взяття патологічного матеріалу для дослідження;
— уміти оформляти супровідну документацію;
— уміти проводити первинний посів матеріалу на поживні середовища;
— знати препарати для специфічного лікування та профілактики особливо небезпечних інфекцій.
Оснащення: мікроскопи, системи індикаторні паперові для ідентифікації вібріонів, мікропрепарати промислового виробництва, імерсійне масло, протичумний костюм, препарати для специфічної профілактики і лікування хвороб, спричинених збудниками особливо небезпечних інфекцій.
План
1. Ознайомлення з особливостями взяття матеріалу від хворого або підозрілого на особливо небезпечну інфекцію для бактеріологічного дослідження та його транспортування.
2. Ознайомлення з типами протичумних костюмів, правилами їх використання.
3. Вивчення морфологічних і тинкторіальних властивостей збудників особливо небезпечних інфекцій.
4. Ознайомлення з методами діагностики особливо небезпечних інфекцій.
5. Ознайомлення з препаратами для специфічної профілактики і лікування хвороб, спричинених збудниками особливо небезпечних інфекцій.
Хід заняття
1. Ознайомлення з особливостями взяття матеріалу від хворого або підозрілого на особливо небезпечну інфекцію для бактеріологічного дослідження та його транспортування
' Завдання 1. Ознайомтеся з правилами взяття матеріалу від хворого або підозрілого на особливо небезпечну інфекцію для бактеріологічного дослідження.
Для забезпечення постійної готовності лікувальних закладів до роботи в умовах епідемічних спалахів існують спеціальні укладки для взяття патологічного матеріалу від хворих з підозрою на особливо небезпечну інфекцію і укладки спеціального захисного одягу. В укладку для відбору матеріалу поміщають посуд і інструменти для взяття матеріалу, інструкцію, відповідно до якої слід проводити взяття, направлення, дезінфекційні засоби. Як спеціальний одяг використовують протичумний костюм І типу. Усі медичні заклади повинні мати запас засобів особистої екстреної профілактики та схеми їх використання. У період епідемічного благополуччя вони постійно зберігаються у відділеннях лікарень і бактеріологічних лабораторіях. Існує декілька різних укладок для взяття патологічного матеріалу від хворого або підозрілого на хворобу, а також від трупа і для взяття патологічного матеріалу із об'єктів навколишнього середовища. Посуд та інструментарій складають в окремий бікс або ящик. Стерилізація елементів укладки проводиться один раз на 3 міс. Дезінфекційні засоби зберігають у спеціальному біксі, вони періодично підлягають заміні.
Матеріал від хворого або підозрілого на захворювання відбирають негайно після виявлення хвороби, обов'язково до початку антибіотикотерапії.
Після взяття патологічного матеріалу для дослідження на посуд із матеріалом наклеюють лейкопластир, на якому простим олівцем ставлять номер, пишуть назву матеріалу. В направленні зазначають також номер, прізвище, ім'я та по батькові хворого, місце роботи або навчання, професію, дату захворювання, дату і час взяття матеріалу. Направлення підписує особа, що забирала матеріал. Матеріал пакують в окремий бікс або в ящик з перегородками, опечатують, на кришці зазначають "верх", "обережно", направлення вміщують у поліетиленовий пакет і відправляють у лабораторію з посильним на спеціальному транспорті.
Дослідження проводять у спеціалізованих лабораторіях, що мають дозвіл Центральної режимної комісії МОЗ України на роботу з матеріалом, зараженим або підозрілим на зараження мікроорганізмами І—II груп патогенності.
2. Ознайомлення з типами протичумних костюмів, правилами їх використання
Завдання 2. Ознайомтеся з типами протичумних костюмів, правилами їх використання.
Захисний протичумний костюм призначений для захисту від зараження збудниками інфекційних захворювань І—II груп небезпеки при всіх основних механізмах передачі: через укус кровосисними комахами, повітряно-краплинним шляхом і під час безпосереднього контакту із зараженим матеріалом.
До складу захисного костюма (мал. 7) входять: комбінезон або піжама, шкарпетки, капці, медична шапочка або косинка, гумові рукавички, гумові або кирзові чоботи чи глибокі калоші, ватно-марлева маска (протипиловий респіратор) або фільтруючий чи киснево-ізолюючий протигаз, захисні окуляри типу "пілотні", рушник. За потреби костюм доповнюють прогумованим або поліетиленовим фартухом і такими самими нарукавниками.
Комбінезон шиють із щільної тканини (бязі або полотна); спереду роблять глуху застібку на ґудзиках, на кінцях штанин
1 рукавів — зав'язки.
Халат шиють також із бязі або полотна за типом хірургічного але значно довший — до нижньої третини гомілки; поли мають глибоко заходити одна за одну; поясок складається з
2 частин, які окремо пришиті до кожної поли; довжина поясу повинна бути такою, щоб його можна було зав'язати петлею. Біля високого комірця пришивають зав'язки за тим самим типом, що і поясок. До рукавів пришивають одну довгу зав'язку.
Капюшон шиють з тієї самої тканини, він має повністю закривати лоб, щоки, шию і підборіддя.
Косинка повинна мати розміри 90x90x125 см.

|
Ватно-марлеву маску виготовляють із марлі завдовжки 125 см і завширшки 50 см. Посередині кладуть шар вати завдовжки 2 5 см, завширшки 17 см, завтовшки 1,5—2 см (20 г). Краї марлі загинають і під верхній її край кладуть 3 шматочки вати. Довгі кінці марлі розрізають вздовж, не доходячи до ватного шару (довжина розрізу 50 см). Після цього маску складають, загортають у папір, у якому потім стерилізують.
Окуляри використовують "пілот-ні", з вигнутими скельцями і широкими краями, які щільно прилягають до обличчя. Окуляри можуть мати іншу конструкцію, яка забезпечує їх герметичність. Для одноразового використання замість окулярів можна використовувати прозорий целофан.
Гумові рукавички беруть хірургічні або анатомічні.
Залежно від характеру роботи ви-
користовують різні типи захисних Мал. 7. Захисний
костюмів: протичумний костюм
• І тип: комбінезон, велика косин- І типу
ка (капюшон), протичумний халат (зав'язка позаду), ватно-марлева маска (респіратор, протигаз), окуляри, гумові рукавички, рушник, шкарпетки, капці, чоботи (гумові або кирзові), фартух, нарукавники і друга пара рукавичок;
II тип: все перераховане, але без окулярів; І і II тип костюма надягають для роботи в заразному блоці або в осередку інфекції;
III тип: замість комбінезону — піжама, замість чобіт — калоші, немає окулярів і ватно-марлевої маски;
IV тип: піжама, шапочка, хірургічний халат, шкарпетки,
капці; його використовують у бактеріологічній лабораторії.
Надягаючи костюм, слід чітко дотримуватися певної послідовності: комбінезон (чи піжама), шкарпетки, тапці, капюшон (чи велика косинка), халат, чоботи. Зав'язки біля комірця халата, а також поясок зав'язують спереду на лівому боці обов'язково петлею, після чого закріплюють зав'язки на рукавах. Респіратор (чи маску) надягають на обличчя так, щоб були закриті рот і ніс, тому верхній край маски має розміщуватися на рівні нижньої частини орбіт, а нижній — під підборіддям. Верхні зав'язки маски зав'язують петлею на потилиці, а нижні — на тім'ї (за типом пращовидної пов'язки). Після надягання респіратора (чи маски) по боках носа закладають ватні тампони для того, щоб повітря не проходило поза маскою.
Окуляри перевіряють на герметичність і міцність скелець, натирають спеціальним олівцем або сухим милом, щоб не пітніли. У місцях можливого проникнення повітря закладають ватні тампони.
Гумові рукавички перед надяганням перевіряють на цілість.
За поясок халата з правого боку закладають рушник.
Перед розтином трупу людей чи тварин додатково надягають фартух, нарукавники, другу пару гумових рукавичок.
Якщо необхідно користуватися фонендоскопом, його надягають перед капюшоном або великою косинкою.
Знімають костюм повільно, у певній послідовності. Після знімання кожної частини костюма руки в рукавичках опускають у дезінфекційний розчин.
Спочатку протирають у напрямку з верху до низу чоботи або калоші тампоном, змоченим дезінфекційним розчином; знімають рушник; протирають дезінфекційним розчином фартух, знімають його і складають внутрішньою поверхнею всередину; знімають нарукавники і другу пару рукавичок; потім знімають фонендоскоп; окуляри відтягують двома руками вперед, уверх і назад за голову; маску розв'язують і знімають, не торкаючись обличчя зовнішньою її поверхнею; розв'язують зав'язки комірця халата, поясок і, опустивши верхній край рукавичок, розв'язують зав'язки рукавів, знімають халат, загортаючи зовнішню поверхню всередину; знімають косинку, збираючи всі її кінці в одну руку на потилиці; знімають рукавички (цілість їх перевіряють у дезінфекційному розчині, а не повітрям); знімають чоботи. Після зняття захисного костюма руки обробляють 70 % етиловим спиртом, ретельно миють туалетним милом, потім миються під душем.
Увесь захисний одяг знезаражується після одноразового використання замочуванням у дезінфекційному розчині, авто-клавуванням або кип'ятінням.
3. Визначення морфологічних і тинкторіальних властивостей збудників особливо небезпечних інфекцій у мікропрепаратах
Завдання 3. Визначте морфологічні і тинкторіальні властивості збудників особливо небезпечних інфекцій у мікропрепаратах або на таблиці.
Увага! Розгляньте під мікроскопом препарати, що містять збудника чуми, туляремії, холери, бруцельозу, сибірки, або таблиці. Зверніть увагу на форму бактеріальних клітин, їх відносний розмір (великі, дрібні, товсті, тонкі), наявність спори і капсули, взаємне розміщення клітин, забарвлення.
. 4. Ознайомлення з методами діагностики особливо небезпечних інфекцій
Завдання 4. Ознайомтеся з методами діагностики особливо небезпечних інфекцій, (див. підручник, тема 11).
Останнім часом для прискореної ідентифікації збудників інфекційних хвороб (у тому числі збудників холери) використовують системи індикаторні паперові (СІП).
Системи індикаторні паперові для ідентифікації вібріонів — це диски або паперові стрічки, просякнуті відповідними реактивами. Вони призначені для диференціації бактерій роду Vibrio від схожих з ними бактерій, а також для визначення ферментативних груп вібріонів за Хейбергом, у тому числі для експрес-діагностики холери. їх випускають у вигляді набору, який дає змогу визначити 13 біохімічних ознак: ферментацію глюкози, лактози, сахарози, маннози, арабінози, маніту, інозиту, лізину, орнітину, аргініну, наявність ферментів оксидази, уреази і здатність утворювати індол.
Системи індикаторні паперові можна використовувати у комплексі з експрес-методами, коли досліджується 1 колонія або чиста культура. У пробірки з 1 % пептонною водою і протихолерною сироваткою додають культуру і опускають диски. Через 3—5 год інкубації за 37 °С одночасно враховують реакцію аглютинації та ферментативну активність.
В іншому випадку, під час постановки проби з холерними діагностичними фагами по колу цієї чашки на місця, вільні від фага, кладуть диски з вуглеводами. Результат враховують через 5 год інкубації.

5. Ознайомлення з препаратами для специфічної профілактики і лікування особливо небезпечних
інфекцій
Завдання 5. Ознайомтеся з препаратами для специфічної профілактики і лікування особливо небезпечних інфекцій, визначте принципи та придатність їх до використання.
Контрольні запитання
1. Як забезпечується постійна готовність лікувальних закладів в умовах виникнення хвороб, спричинених збудниками особливо небезпечних інфекцій?
2. Як відбирають матеріал у хворого або підозрілого на особливо небезпечну інфекцію? Як його оформляють і доставляють в лабораторію?
3. Які існують типи захисних протичумних костюмів? Яких правил слід дотримуватися під час надягання і знімання протичумного костюма?
4. Яка особливість морфологічних і тинкторіальних властивостей збудників особливо небезпечних інфекцій?
5. Які методи використовують для лабораторної діагностики холери, чуми, туляремії, бруцельозу, сибірки?
6. У чому перевага використання систем індикаторних паперових?
7. Які препарати використовують для профілактики і лікування хвороб, спричинених збудниками особливо небезпечних інфекцій?
Тести
1. Середовищем накопичення для V. cholerae є:
а) 1 % пептонна вода;
б) МПБ;
в) МПА;
г) лужний агар.
2. Експрес-діагностику особливо небезпечних інфекцій прово-
дять методом:
а) алергійним;
б) біологічним;
в) серологічним;
г) люмінесцентно-серологічним.
3. Реакцію Хеддльсона ставлять для діагностики:
а) чуми;
б) туляремії;
в) бруцельозу;
г) сибірки.
4. Для виявлення антигену збудника сибірки в старих шкурах
використовують реакцію:
а) Райта;
б) Асколі;
в) Бюрне;
г) Хеддльсона.
5. Збудником чуми є:
а) Y. enterocolitica;
б) Y. pestis;
в) Y. pseudotuberculosis.
6. Основним фактором патогенності збудника сибірки є:
а) капсула;
б) фактор набряку;
в) фактор протективного антигену;
г) летальний фактор.
7. Синантропні гризуни можуть бути резервуаром і джерелом
збудників:
а) Y. enterocolitica;
б) Y. pseudotuberculosis;
в) F. tularensis;
г) всі відповіді правильні.
Ситуаційні задачі
1. Під час мікроскопії рідини зі струпа виявлено великі грампозитивні стрептобацили, оточені капсулою. До якого виду орієнтовно можна віднести ці мікроорганізми? Які дослідження слід провести для уточнення видової приналежності цієї культури?
2. Під час мікроскопії краплі випорожнень було виявлено тоненькі, ледь зігнуті грамнегативні палички. До якого роду орієнтовно можна віднести ці мікроорганізми? Які дослідження слід провести для уточнення родової приналежності цієї культури?
3. У гуртожитку виявили хворого на холеру. Які препарати слід використати для проведення екстреної профілактики холери у контактних?
4. Із сироваткою крові хворого на туляремію поставили реакцію аглютинації з туляремійним діагностикумом. Титр сироватки виявився 1:100. Чи можна на основі цих результатів підтвердити діагноз?
5. Для масового обстеження населення на бруцельоз використовують алергійний метод діагностики. Який препарат при цьому використовують? Як його вводять? Як враховують результат?
Домашнє завдання
Підготуйтеся до практичного заняття 11.
Рекомендації щодо самопідготовки до практичного заняття 11
1. Ознайомтеся з темою і метою практичного заняття, запишіть у щоденнику тему і план заняття.
2. Вивчіть теоретичний матеріал (див. підручник, с. 278— 303; практикум, с. 123—136).
Практичне заняття 11
^ ЛАБОРАТОРНА ДІАГНОСТИКА ХВОРОБ, СПРИЧИНЕНИХ ЗБУДНИКАМИ ПОВІТРЯНО-КРАПЛИННИХ БАКТЕРІАЛЬНИХ ІНФЕКЦІЙ
у Мета заняття:
— уміти проводити взяття патологічного матеріалу для дослідження;
— уміти оформляти супровідну документацію;
— уміти проводити первинний посів матеріалу на поживні середовища;
— знати препарати для специфічного лікування та профілактики.
Оснащення: тампони для зіва і носа на алюмінієвому дроті, шпатель для зіва, середовища виготовлені стерильні та з ростом відповідної культури: КА, кров'яно-телуритовий агар (КТА); казеїново-вугільний агар (КВА), середовище Борде—Жангу з додаванням антибіотиків, мікроскопи світловий і бінокулярний стереоскопічний, імерсійне масло, баночка для збирання мокротиння, спиртівка, сірники, маркер, пінцет, шпатель для посіву, мікропрепарати промислового виготовлення, препарати для специфічної профілактики (АКДП, БЦЖ), протидифтерійна сироватка і лікувальні препарати, календар профілактичних щеплень.
План
1. Взяття матеріалу у разі обстеження на дифтерію, заповнення направлення, підготовка до транспортування, проведення первинного посіву патологічного матеріалу.
2. Вивчення культуральних властивостей коринебактерій, визначення морфологічних і тинкторіальних властивостей коринебактерій у мікропрепаратах.
3. Взяття патологічного матеріалу для дослідження за підозри на коклюш, проведення первинного посіву на середовища КВА і Борде—Жангу.
4. Вивчення культуральНих, морфологічних і тинкторіаль-них властивостей бордетел у мікропрепаратах.
5. Ознайомлення з методами відбору патологічного матеріалу для мікробіологічного дослідження за підозри на туберкульоз, умовами його транспортування.
6. Вивчення морфологічних і тинкторіальних властивостей мікобактерій туберкульозу у мікропрепаратах.
7. Ознайомлення з препаратами для профілактики і лікування повітряно-краплинних бактеріальних інфекцій.
/ Хід заняття
1. Взяття матеріалу у разі обстеження на дифтерію, заповнення направлення, підготовка до транспортування, проведення первинного посіву патологічного матеріалу
Для взяття матеріалу використовують сухі і зволожені тампони. Зволоясені тампони застосовують у разі транспортування матеріалу на великі відстані.
Оскільки при первинній дифтерії патологічний процес локалізується у ротоглотці і носі, то за будь-якої локалізації патологічного процесу обов'язково відбирають матеріал із ротоглот-ки і носа, а при дифтерії незвичайної локалізації (здебільшого вторинна дифтерія) відбирають додатково матеріал із місця ураження: ока, вуха, шкіри, піхви, рани.
Із ротоглотки матеріал беруть натще або не раніше ніж через 2 год після споживання їжі. Під час ларингоскопії матеріал забирають із гортані. У разі оперативного втручання відбирають плівки, а також слиз із інтубаційної трубки. У разі взяття матеріалу з ураженої ділянки шкіри її спочатку протирають "промокальними" рухами стерильною марлевою серветкою, змоченою стерильним ізотонічним розчином натрію хлориду, потім обережно піднімають або відгортають краї плівки і відбирають матеріал сухим тампоном на межі здорової й ураженої ділянок. В усіх випадках матеріал відбирають до початку антибіотико-терапії або не раніше ніж через 3 доби після відміни лікування, щоб уникнути бактеріостатичної дії антибактеріальних препаратів на збудника.
Після смерті хворого відбирають матеріал з мигдаликів, гортані і носа.

Завдання 1. Візьміть патологічний матеріал у разі обстеження на дифтерію.
Алгоритм "Взяття патологічного матеріалу у разі обстеження на дифтерію":
— поставте у штатив 2 пробірки з сухими стерильними там-
"^\_ понами, на яких зазначена дата їх стерилізації;
— зазначте на пробірці одного тампона номер аналізу і літеру "З" (зів), на пробірці іншого тампона — номер аналізу і літеру "Н" (ніс);
— запропонуйте пацієнту сісти проти джерела світла і широко відкрити рот;
— притисність шпателем корінь язика;
— огляньте уважно порожнину рота, зверніть увагу на наявність чи відсутність плівок, нальотів на мигдаликах, язичку, дужках піднебіння;
— візьміть тампоном із пробірки "З" матеріал обертальними рухами (у разі відсутності ураження) з мигдаликів, дужок піднебіння, язичка і задньої стінки глотки;
— візьміть тампоном із пробірки "З" матеріал (за наявності плівок, нальотів) на межі ураженої і здорової тканини, злегка натискуючи тампоном на плівку чи наліт;
Увага! Не можна торкатися тампоном язика, слизової оболонки щік та зубів!
— опустіть тампон у пробірку "З";
— уведіть тампон із пробірки "Н" в один носовий хід до упору і зробіть напівобертальний рух тампоном, натискуючи на внутрішню поверхню крила носового ходу, потім уведіть цей самий тампон в інший носовий хід і проведіть взяття матеріалу таким самим способом;
Увага! Не можна торкатися тампоном до зовнішньої поверхні крил носа!
— опустіть тампон у пробірку "Н".
Завдання 2. Заповніть направлення, підготуйте матеріал до транспортування.
У направленні обов'язково зазначають дату і час відбору матеріалу, прізвище лікаря і номер телефону, за яким можна сповістити попередній результат дослідження; у пункті "на які інфекції провести дослідження" зазначають "на дифтерію" або на БЛ чи ВЬ (бактерія Леффлера).
Пробірки від однієї особи скріплюють разом гумовим кільцем і складають у бікс, дно і стінки якого застелені бавовняною серветкою. Кінцями цієї серветки накривають пробірки, закривають бікс.
Направлення вміщують у поліетиленовий пакет або папку і доставляють окремо від пробірок з тампонами.
Не допускається поміщати направлення у бікс з патологічним матеріалом!
Тампони мають бути доставлені до лабораторії не пізніше З год після взяття матеріалу.
Якщо посів матеріалу проводять біля ліжка хворого, чашки Петрі з посівами доставляють до лабораторії негайно або ставлять у термостат за 37 °С і доставляють до лабораторії не пізніше ніж через 20—23 год. В осінньо-зимовий період на дно бікса або сумки, в яких транспортують чашки чи тампони, кладуть грілку з водою, нагрітою до 40 °С.
На чашках Петрі крім усіх необхідних позначень (назва середовища, номер аналізу, дата посіву, назва посіяного матеріалу) має бути зазначена дата виготовлення середовища.
Проведення первинного посіву патологічного матеріалу
Посів патологічного матеріалу із ротоглотки і носа від однієї особи роблять на одну чашку, засіваючи одним тампоном на половині середовища. За наявності патологічного матеріалу, взятого з місця іншої локалізації, роблять посів на додаткову чашку.
Не допускається посів патологічного матеріалу від декількох осіб на одну чашку!
Первинний посів роблять на зігріті поживні середовища.
Завдання 3. Проведіть первинний посів патологічного матеріалу на поживні середовища КА і КТА.
Алгоритм "Проведення первинного посіву патологічного матеріалу на поживні середовища КА і КТА":
— підпишіть чашки: на кришці чашки зазначте назву середовища і дату його виготовлення; дно чашки поділіть на дві рівні частини, зазначте номер аналізу, назву патологічного матеріалу, дату посіву, на одній половині чашки поставте літеру "З", на іншій — літеру "Н";
— зробіть втирання патологічного матеріалу тампоном "З", повертаючи його навколо своєї осі на окрему ділянку КА площею 2x1 см, потім аналогічно на КТА;
— зробіть цим самим тампоном посів штрихами на решту поверхні середовища, не доходячи до лінії поділу чашки;
Увага! Під час посіву не можна переходити лінію поділу чашки, щоб не змішувалися посіви з різних тампонів!
— зробіть аналогічно посів тампоном "Н" на другу половину середовища КА і КТА;
— поставте чашки з посівами у термостат.
2. Вивчення культуральних властивостей коринебактерій, визначення морфологічних і тинкторіальних властивостей коринебактерій у мікропрепаратах
Завдання 4. Опишіть культуральні властивості коринебактерій на середовищі КТА, вивчіть морфологічні і тинк-торіальні властивості коринебактерій у препараті.
Колонії, що виросли на чашках з середовищами КА і КТА, розглядають через 24 год після посіву матеріалу (якщо посів було проведено у другій половині дня, то і препарат розглядають у другій половині наступного дня) за допомогою стереоскопічного бінокулярного мікроскопа. Через 24 год утворюються колонії дрібні, з рівним краєм, випуклі, сірого кольору, в'язкі; через 48 год — сірі або чорні з металевим блиском, рівними або ледь хвилястими краями, в'язкі чи крихкі.
Розгляньте під мікроскопом препарат, виготовлений із культури С. сИргітЛіегіае. Зверніть увагу на форму бактеріальних клітин, відносний їх розмір, взаємне розташування, колір (залежно від способу фарбування), наявність зернистості.
3. Взяття патологічного матеріалу для дослідження за підозри на коклюш, проведення первинного посіву на середовища КВЛ і Борде—Жангу
З діагностичною метою обстежують дітей за клінічними ознаками або тих, які кашляють протягом 5—7 днів, без ознак запалення у ротоглотці, незалежно від наявності контакту з хворим на коклюш; дорослих з підозрою на коклюш, які працюють у пологових будинках, дитячих лікарнях, дитячих садках і ін., а також дорослих, які працюють з дітьми і кашляють протягом 5—7 днів і більше.
За епідеміологічними показаннями обстежують осіб, які спілкувалися з хворими на коклюш.
Взяття матеріалу на бактеріологічне дослідження з діагностичною метою потрібно проводити у ранній термін захворювання 2—3-разово щодня або через день. Пізніше 3-го тижня захворювання можливість виділення збудника різко знижується.
Для дослідження забирають слиз із задньої стінки глотки. При цьому треба пам'ятати про те, що у верхніх відділах носоглотки знаходяться авірулентні штами, схильні до автолізу, а вірулентні колонізують нижній відділ верхніх дихальних шляхів. Відбір матеріалу можна здійснювати двома способами: задньоглотковим тампоном і методом "кашльових пластинок". Задньоглотковим тампоном матеріал беруть як з метою діагностики, так і за епідеміологічними показаннями, а також у будь-якому випадку у дітей грудного віку. Для цього використовують два тампони: сухий і зволожений. Сухим тампоном роблять посів (обов'язово), а зволожений відправляють до лабораторії. Метод "кашльових пластинок" використовують тільки з діагностичною метою за наявності кашлю.
Завдання 5. Проведіть взяття патологічного матеріалу для дослідження за підозри на коклюш, заповніть направлення.
Алгоритм "Взяття патологічного матеріалу задньоглотковим тампоном, заповнення направлення":
— візьміть у ліву руку стерильну пробірку з тампоном, позначте на ній номер аналізу;
— зігніть правою рукою тампон приблизно на відстані 2 см від кінця об край пробірки під кутом 120° під час виведення тампона з пробірки, тампон тримайте у правій руці;
— візьміть у ліву руку шпатель для зіва;
-— запропонуйте пацієнту широко відкрити рот;
— притримуйте корінь язика шпателем, уведіть тампон зігнутим кінцем донизу у ротоглотку до "відчуття провалу";
Увага! Під час взяття матеріалу не можна торкатися тампоном до слизової оболонки щік, язика, мигдаликів, піднебіння!
— проведіть кінцем тампона і його випуклим боком, торкаючися задньої стінки глотки, справа наліво 2—3 рази;
— вийміть тампон із рота і, розгинаючи, опустіть його у пробірку;
— заповніть направлення.
Проведення первинного посіву на середовища КВА і Борде—Жангу
Посів матеріалу з діагностичною метою проводять паралельно на дві чашки, за епідеміологічними показаннями — на одну. Посів здійснюють на середовища, оброблені антибіотиками для пригнічення сторонньої мікрофлори. Під час взяття матеріалу методом "кашльових пластинок" застосовують середовища без антибіотика, тому що супутня мікрофлора в цьому разі буде незначною. Для посіву обов'язково використовують тепле поживне середовище. У разі взяття матеріалу сухим тампоном посів проводять негайно через низьку стійкість збудника.
Однією з основних умов посіву є отримання ізольованих колоній. Для цього використовують кілька методів посіву. В одному випадку ретельно втирають матеріал тампоном, повертаючи його навколо своєї осі, по периферії середовища у чашці Петрі на 4—5 бляшок, а потім, не торкаючись до них тампоном, роблять у центрі чашки штрих у вигляді літери Ъ. Після підсихання цей штрих ретельно розтирають шпателем, не торкаючись бляшок.
Якщо посів проводять на місці взяття, то матеріал втирають тампоном на одній половині середовища, а потім у лабораторії проводять його розштрихування бактеріологічною петлею ще на 2 сектори.
'/2 5 8-218
Засіяні чашки ставлять у термостат за температури 35— 37 °С. Для зволоження повітря в термостат ставлять відкриту чашку Петрі з водою. У зв'язку з тим що останнім часом відмічається уповільнений ріст В. pertussis, чашки з посівом витримують у термостаті до 7 діб, але проглядають їх щодоби через можливий ріст В. parapertussis і В. bronchiseptica.
Завдання 6. Проведіть первинний посів на середовища КВА і Борде—Жату.
Алгоритм "Проведення первинного посіву па середовища КВА і Борде—Жату":
— візьміть із термостату чашки Петрі з підігрітими середовищами КВА і Борде—Жангу;
— підпишіть чашки;
— зробіть посів матеріалу першим способом, зазначеним вище;
— поставте чашки з посівами у термостат;
— налийте у пусту чашку Петрі дистильовану воду;
— поставте поряд із засіяними чашками відкриту чашку Петрі з дистильованою водою.
4. Вивчення культуральних, морфологічних і тинкторіальних властивостей бордетел у мікропрепаратах
Завдання 7. Вивчіть культуральні властивості бордетел на середовищах КВА і Борде—Жангу, морфологічні і тинкторіальні властивості у препараті.
Колонії бордетел на щільних поживних середовищах випуклі, вологі, гладенькі, блискучі, з рівним краєм, сірого кольору з блакитним, перлинним, металевим, а іноді жовтуватим, зеленкуватим або білуватим відтінком. Промінь світла, що падає збоку на колонії, відбивається її поверхнею, внаслідок чого утворюється світловий конус ("хвостик", "промінець"), що падає від центру колонії на поверхню поживного середовища. Це можна спостерігати в стереоскопічному мікроскопі, спрямовуючи світло від лампи на поверхню середовища з ростом культури бордетел. Колонії В. bronchiseptica можуть бути двох типів: схожі на колонії В. pertussis або білі, плоскі, з піднятим центром. В. pertussis і В. bronchiseptica не змінюють кольору середовищ, В. parapertussis спричинює побуріння середовища КВА і потемніння середовища Борде—Жангу внаслідок розщеплення амінокислоти тирозину. Колонії усіх трьох видів борде-тел мають маслянисту консистенцію, легко знімаються петлею, на середовищі з кров'ю утворюють зони слабкого гемолізу.
Розгляньте колонії бордетел на середовищах КВА і Борде— Жангу неозброєним оком і під стереоскопічним (бінокулярним) мікроскопом зі штучним освітленням. Опишіть властивості підозрілих колоній.
Під час мікроскопії зверніть увагу на відносний розмір клітин (великі чи дрібні, однорідні чи поліморфні), їх форму, взаємне розміщення, забарвлення.
5. Ознайомлення з методами відбору патологічного матеріалу для мікробіологічного дослідження за підозри на туберкульоз, умовами його транспортування
Завдання 8. Ознайомтеся з методами відбору патологічного матеріалу для мікробіологічного дослідження за підозри на туберкульоз, з умовами його транспортування.
Для виявлення збудника туберкульозу відбирають патологічний матеріал: мокротиння, промивні води бронхів, шлунка, сечу, пунктати із закритих порожнин (спинномозкову рідину, ексудати і трансудати з плевральної і черевної порожнин), гній із нориць, виділення ран, менструальну кров, виділення з відкритих порожнин.
Патологічний матеріал слід відбирати до початку лікування або після дводенної перерви у вживанні антибактеріальних препаратів. При легеневій формі туберкульозу відбирають мокротиння.
Медичний працівник повинен детально пояснити хворому правила збирання мокротиння і видати йому стерильну скляну широкогорлу банку з кришкою (плювальницю). Взяття мокротиння треба проводити у присутності медичного працівника. Для запобігання зараженню туберкульозом медичний працівник повинен бути у шапочці, масці, клейончастому фартусі, гумових рукавичках і стояти за спиною пацієнта.
Збирання мокротиння проводиться у спеціально призначеному для цієї процедури приміщенні, яке обладнане вентиляційними установками і бактерицидними лампами.
І
Мокротиння збирають у ранкові години. Якщо його виділяється мало, збирають протягом доби і зберігають у холодильнику, не допускаючи замороження. Для посилення секреції бронхіального вмісту хворому дають відхаркувальні препарати або застосовують подразнювальну аерозольну інгаляцію. Перед збиранням мокротиння хворий повинен почистити зуби без пасти, прополоскати рот, сплюнути носоглотковий слиз і слину в дезінфекційний розчин. Відкашлювати мокротиння потрібно з глибоких нижніх дихальних шляхів. Для цього хворий повинен зробити декілька глибоких вдихів, потім похаркати у плювальницю і перевірити наявність у посуді мокротиння (не менше ніж 10 см3). Відбирають 3 проби мокротиння. Першу пробу мокротиння беруть у хворого в день звернення його за медичною допомогою в присутності медичного персоналу. Потім йому дають посуд для збирання ранкового мокротиння (хворий самостійно збирає другу пробу). Останню (третю) пробу збирають у присутності медпрацівника у день доставки другої проби.
Зібране мокротиння заливають консервантом у співвідношенні 1:1 і герметично закривають кришкою.
Як консервант використовують 10 % розчин натрію фосфату, 5—10 % розчин гліцерину, 10 % розчин натрію хлориду або 2—3 % розчин борної кислоти. Розчин борної кислоти використовують в умовах спекотного клімату.
За відсутності у хворого мокротиння відбирають промивні води бронхів (маніпуляцію виконує лікар-отоларинголог).
У дітей здебільшого відбирають промивні води шлунка (діти ковтають мокротиння). Для цього останнє споживання їжі хворим має бути не пізніше 12 год до взяття матеріалу. Хворому дають випити 200 см3 дистильованої води, потім уводять шлунковий зонд і збирають вміст шлунка у стерильну склянку.
Сечу збирають у стерильний флакон. Після ретельного туалету зовнішніх статевих органів відбирають середню порцію ранкової сечі. З ниркових мисок сечу забирають катетером з кожної нирки окремо.
Спинномозкову рідину відбирають за підозри на менінгоен-цефаліт так само, як при менінгококовій інфекції.
Ексудати, трансудати з плевральної і черевної порожнин беруть стерильним шприцом у стерильний посуд.
Кров відбирають капілярну або венозну за загальноприйнятими методиками. Менструальну кров відбирають методом відсмоктування за допомогою ковпачка Кафка.
Гній із нориць, виділення ран, виділення з відкритих порожнин беруть стерильним шприцом або стерильним ватним тампоном у стерильний посуд.
На посуд із зібраним для аналізу матеріалом наклеюють етикетку, в якій зазначають прізвище хворого і адресу. Крім того, заповнюють направлення.
Посуд встановлюють у дерев'яний ящик із гніздами, спеціальний контейнер або металевий бікс і негайно доставляють до лабораторії. Направлення доставляють у поліетиленовому пакеті або папці.
6. Вивчення морфологічних і тинкторіальних властивостей мікобактерій туберкульозу у мікропрепаратах
Завдання 9. Розгляньте під мікроскопом препарати, виготовлені з мокротиння і пофарбовані за Цілем—Нільсеном.
Зверніть увагу на форму клітин, їх відносний розмір, взаємне розміщення, а також на інші елементи, що виявляються у полі зору (лейкоцити, еластичні волокна, клітини миготливого епітелію, інші бактерії).
7. Ознайомлення з препаратами для профілактики і лікування повітряно-краплинних бактеріальних інфекцій
Завдання 10. Ознайомтеся з препаратами для профілактики і лікування дифтерії, коклюшу і туберкульозу.
Уважно прочитайте інструкції до вакцин АКДП, БЦЖ, АДП, АД, продивіться ампули з вакцинами, прочитайте, що зазначено на етикетці, зверніть увагу на цілість ампул, фізичні властивості препарату (колір, агрегатний стан). Визначте, чи придатний препарат для використання. Визначте за календарем профілактичних щеплень терміни вакцинації і ревакцинації вакцинами АКДП, БЦЖ.
Ознайомтеся з інструкцією до протидифтерійної сироватки, принципом її використання.
Прочитайте інструкції до лікарських препаратів, зверніть увагу на їх форму випуску. Визначте придатність їх до використання.
Контрольні запитання
1. Які середовища використовують для первинного посіву матеріалу, що містить коринебактерії?
2. Який матеріал беруть на дослідження при дифтерії різної локалізації? Які тампони використовують для взяття матеріалу?
3. Як проводять взяття матеріалу з ротоглотки у разі відсутності видимих уражень і за наявності плівок і нальотів?
4. Як проводять взяття матеріалу з носа?
5. Яких правил дотримуються під час взяття матеріалу на дослідження при дифтерії незвичайних локалізацій?
6. Яких правил дотримуються під час транспортування матеріалу і направлень до лабораторії?
7. Яких правил дотримуються під час проведення первинного посіву матеріалу?
8. За якими ознаками відбирають колонії коринебактерій із середовищ первинного посіву?
9. За якими ознаками визначають коринебактерії у мікро-препараті?
10. Який матеріал і якими методами відбирають для дослідження за підозри на коклюш? За яких умов його транспортують?
11. Які середовища використовують для первинного посіву? Яким вимогам вони повинні відповідати?
12. Який матеріал відбирають на дослідження при туберкульозі?
13. Як проводять взяття мокротиння для лабораторного дослідження? Як транспортують матеріал до лабораторії?
14. Якими методами виявляють мікобактерії у патологічному матеріалі?
15. Які вакцини і в який термін використовують для проведення вакцинації та ревакцинації проти дифтерії, коклюшу, туберкульозу?
16. За яким принципом використовують протидифтерійну сироватку? За яким методом її вводять в організм?
Тести
1. Під час профілактичного обстеження на дифтерію матеріал
відбирають із:
а) задньої стінки глотки;
б) носоглотки та носа;
в) ротоглотки та носа;
г) методом "кашльових пластинок".
2. Середовище для первинного посіву на дифтерію:
а) КТА;
б) КВА;
в) сироватковий агар;
г) середовище Левенштейна—Ієнсена.
3. Матеріал, що містить В. pertussis, транспортують за темпе-
ратури:
а) 4-37 °С;
б) 37—40 °С;
в) 2—25 °С;
г) 25—40 °С.
4. Середовище для первинного посіву на коклюш:
а) КТА;
б) КВА;
в) сироватковий агар;
г) середовище Левенштейна—Ієнсена.
5. Ріст колоній В. pertussis з'являється через:
а) Ідобу;
б) 1—2 доби;
в) 3-7 діб;
г) 3—6 міс.
6. Для профілактики туберкульозу використовують препарат:
а) АКДП;
б) туберкулін;
в) БЦЖ;
г) ЖБВ.
Ситуаційні задачі
1. Особа була проімунізована проти дифтерії згідно з календарем щеплень за віком. Чи підлягає вона позаплановій ревакцинації в разі виникнення спалаху інфекції?
2. Під час серологічного дослідження сироватки крові дітей 1—2 років життя, хворих на коклюш, реакції часто бувають негативними. Чим пояснити такий результат?
3. Під час постановки реакції Манту діаметр папули у дитини виявився 5 мм. Під час повторної постановки цієї реакції через рік діаметр папули виявився 8 мм. Який висновок слід зробити щодо інфікованості організму збудником туберкульозу? Чи можна дитині проводити ревакцинацію проти туберкульозу?
4. У корів, хворих на туберкульоз, мікобактерії туберкульозу виділяються з молоком. Чи можна таке молоко споживати після кип'ятіння протягом 1 хв?
Домашнє завдання
Підготуйтесь до практичного заняття 12.
Рекомендації щодо самопідготовки до практичного заняття 12
1. Ознайомтеся з темою і метою практичного заняття, запишіть у щоденнику тему і план заняття.
2. Вивчіть теоретичний матеріал (див. підручник, с. 304— 325; практикум, с. 137—145).
Практичне заняття 12
ЛАБОРАТОРНА ДІАГНОСТИКА ХВОРОБ, СПРИЧИНЕНИХ ОБЛІГАТНИМИ АНАЕРОБАМИ
Мета заняття:
— уміти проводити взяття патологічного матеріалу для дослідження;
— уміти оформляти супровідну документацію;
— уміти проводити первинний посів матеріалу на поживні середовища;
— знати препарати для специфічної профілактики та лікування хвороб, спричинених облігатними анаеробами.
Оснащення: анаеростат, ексикатор, культура анаеробів у напіврідкому середовищі у трубках Віньяля—Вейона, на середовищах МПА, КА у чашках Петрі, на середовищах Вільсона—Блера і Кітта—Тароцці, мікропрепарати промислового виробництва, мікроскопи, імерсійне масло, препарати
для специфічної профілактики і лікування.
і
План
1. Ознайомлення з правилами взяття матеріалу для дослідження з метою виявлення анаеробів. Оформлення супровідної документації.
2. Ознайомлення з методами культивування анаеробів.
3. Визначення клостридій і бактероїдів у мікропрепаратах.
4. Вивчення імунологічних препаратів, які використовують для профілактики і лікування захворювань, спричинених анаеробами.
Хід заняття
1. Ознайомлення з правилами взяття матеріалу для дослідження з метою виявлення анаеробів. Оформлення супровідної документації
Завдання 1. Ознайомтеся з правилами взяття матеріалу для дослідження з метою виявлення анаеробів. Оформіть супровідну документацію.
■ Мікробіологічні дослідження при всіх захворюваннях, спричинених клостридіями і бактероїдами, проводять у двох напрямах: виділення із патологічного матеріалу збудника і виявлення у патологічному матеріалі токсину. Для виявлення збудника патологічний матеріал висівають на поживні середовища, виділяють чисту культуру й ідентифікують її. Наявність токсину в патологічному матеріалі виявляють у біопробі, тип токсину визначають у реакції нейтралізації на білих мишах.
При ранових анаеробних інфекціях досліджують такий матеріал: кірочки, виділення з рани або тканина рубця, тканини, що були видалені під час хірургічного оброблення рани, сторонні тіла (кулі, колючки, обривки одягу тощо), кров хворого. У жінок, хворих на правець унаслідок пологів або абортів, на аналіз відбирають виділення з матки, у новонароджених — виділення з пупка. Ґрунт досліджують з метою визначення його забрудненості анаеробами та їх токсинами.
Матеріал із рани відбирають до початку оброблення її антисептиками й антибіотиками. Виділення з рани і рідину з набряку відбирають стерильним ватним тампоном або стерильною піпеткою.
Шматочки тканин беруть за можливості з глибоких ділянок рани, карманів, роздавлених тканин. Одночасно з різних ділянок рани роблять мазки, які відправляють до лабораторії разом із відібраним матеріалом.
Кров відбирають із вени стерильним шприцом у стерильну пробірку до введення антитоксичної сироватки з метою виявлення в ній токсину (слід враховувати, що токсин у крові хворого на правець виявляється тільки в продромальний період; в інкубаційний період та період розпалу інфекції токсин у крові не виявляється).
Основними правилами під час взяття і транспортування патологічного матеріалу є оберігання відібраного зразка від контакту з атмосферним повітрям. Тому матеріал краще відбирати і транспортувати у шприцах, мазки — у спеціальних контейнерах. Після взяття матеріалу заповнюють направлення. Матеріал транспортують в анаеробних умовах.
2. Ознайомлення з методами культивування анаеробів
Завдання 2. Вивчіть методи культивування облігатних анаеробів.
Особливість облігатних анаеробів полягає в тому, що вони можуть існувати і розмножуватися за умов майже повної відсутності кисню (хоча серед них також є мікроорганізми, що більше і менше чутливі до кисню). Для їх культивування потрібно створити умови, за яких молекулярний кисень видаляється з поживного середовища і навколишнього простору, де перебуває культура облігатних анаеробів.
Залежно від способу видалення кисню розрізняють такі методи їх культивування: фізичні, хімічний і біологічний.
Фізичні методи ґрунтуються на механічному видаленні або запобіганні проникненню кисню в поживне середовище або в навколишній простір.
|
Вирощування в анаерос-
таті. Анаеростати бувають
стаціонарні і портативні.
Анаеростат — це товстостін-
ний металевий апарат пря-
мокутної або циліндричної
форми з дверцятами або
кришкою, які герметично
закриваються (мал. 8). Ат-
мосферний тиск у робочій
камері апарату вимірюється
вакуумметром, шкала яко-
го розрахована від "0" (що
означає нормальний атмос-
ферний тиск — 1 атм) до
(що означає повний вакуум).
Видалення повітря прово-
дять через кран, який потім
щільно закривають. Посуд з
посівом (частіше чашки Пе-
трі) вміщують у робочу ка-
меру апарата, апарат щільно
закривають, повітря з каме-
ри видаляють за допомогою Мал. 8. Анаеростат
вакуум-насоса. Культивують мікроорганізми у вакуумі або в атмосфері газу, що не містить кисню. В останньому випадку у робочу камеру анаеростата подають азот, суміш азоту і вуглекислого газу, водень, пропан з бутаном. Стаціонарний анаерос-тат підключають до електромережі, а портативний ставлять у термостат. Анаероби ростуть повільно, тому анаеростат відкривають через 4—5 діб.
Метод Віньяля—Вейона. У пробірку з розплавленим і охолодженим до 43—45 °С напіврідким агаром піпеткою вносять досліджуваний матеріал і добре перемішують. Потім агаром з посівом заповнюють стерильну пастерівську піпетку, яка з одного кінця щільно закрита ватною пробкою. Піпетку заповнюють до кінця, не допускаючи попадання повітря. Нижній кінець піпетки запаюють у полум'ї спиртівки. Засіяні піпетки вміщують у велику пробірку, на дні якої накладена вата, або загортають у щільний папір і поміщають у термостат. Колонії мікроорганізмів добре видно через скло. Вони мають вигляд двояковипуклої лінзи або жмутика вати. Після культивування роблять надріз піпетки терпугом поряд з колонією, ламають піпетку, зафламбованою петлею відбирають колонію і пересівають її на стерильне поживне середовище для виділення чистої культури анаеробів.
, Культивування у високому стовпчику агару. Щільне середовище (наприклад, Вільсона—Блера) наливають у велику хімічну пробірку на 2/3 її висоти. Перед посівом його розплавляють і охолоджують до температури 43—45 °С. Швидко роблять посів піпеткою, добре перемішують (прокручують пробірку між долонями рук) і ставлять у банку з холодною водою, щоб не відбулося насичення середовища киснем з повітря. Після ущільнення агару пробірки поміщають у термостат для культивування мікроорганізмів. Анаероби ростуть у нижній частині середовища.
Застосування поживного середовища Вільсона—Блера для культивування облігатних анаеробів ґрунтується на тому, що воно має щільну консистенцію, наливається високим стовпчиком, містить у собі глюкозу (редукуюча речовина). Крім того, воно містить натрію сульфіт і заліза хлорид(ІІ). Під впливом анаеробів натрію сульфіт відновлюється до натрію сульфіду, який після взаємодії із заліза хлоридом(ІІ) утворює заліза сульфід — речовину чорного кольору. Тому анаероби у середовищі Вільсона—Блера утворюють колонії чорного кольору.
Метод Перетца. Посівний матеріал наносять бактеріологічною петлею чи пастерівською піпеткою на середовище МПА в чашку Петрі, рівномірно розсівають шпателем. На поверхню посіву кладуть зафламбоване стерильне предметне скло так, щоб під склом не залишилося кульок повітря. Чашки Петрі ставлять у термостат донизу дном. Анаероби виростають під склом, поряд зі склом ростуть аероби. Враховують ті колонії, які ростуть під склом на відстані, не ближчій ніж 0,5 см від краю скла.
Під час культивування облігатних анаеробів у рідких поживних середовищах спочатку проводять їх регенерацію (кип'ятять середовища на водяній бані 20—ЗО хв для видалення повітря). Потім середовище різко охолоджують і роблять посів (регенеровані середовища мають бути використані протягом 20—ЗО хв, в іншому разі їх повторно регенерують). Після посіву середовище заливають стерильним вазеліновим маслом шаром 1—1,5 см. До таких поживних середовищ належить середовище Кітта—Тароцці. На ньому анаероби утворюють дифузний ріст, унаслідок чого воно мутніє.
Хімічний метод ґрунтується на видаленні кисню хімічними речовинами. Для поглинання кисню з навколишнього простору використовують метод Арістовського. На дно ексикатора поміщають хімічні речовини, які легко поглинають кисень із повітря (натрію гідросульфіт або багатоатомний фенол — пірга-лол). У розширену частину ексикатора поміщають чашки Петрі з посівами і щільно закривають кришкою. Ексикатор ставлять в термостат.
Для поглинання кисню з поживного середовища до нього додають редук






