краткий способ описания химической реакции. Символы, обозначающие вступающие в реакцию вещества, находятся в левой части уравнения, а обозначения продуктов реакции - в правой:
 <="" div="" style="border-style: none;">
<="" div="" style="border-style: none;">
где в скобках указано агрегатное состояние, Q - тепловой эффект реакции. Это уравнение описывает химическую реакцию между натрием и хлором с образованием хлорида натрия (поваренная соль). Натрий - металл, бурно реагирующий с водой, хлор - ядовитый газ, но, соединяясь друг с другом, эти элементы образуют вполне безвредное вещество, необходимое для жизни. Это пример реакций присоединения. Известны также химические реакции замещения, обмена, разложения и пр.; реакции могут быть обратимые, ионные, окислительно-восстановительные, ядерные и др. в зависимости от принципа классификации реакций: по формальному признаку, по механизму реакций, по термодинамическим или кинетическим параметрам и т.д.
См. также ПРЕВРАЩЕНИЯ ВЕЩЕСТВ. Реакции присоединения X + Y -> XY Примеры:
 <="" div="" style="border-style: none;">
<="" div="" style="border-style: none;">
Число атомов данного элемента в левой части уравнения равно числу этих атомов в правой части, другими словами, вещество в ходе химической реакции не возникает из ничего и не уничтожается. Химическая реакция, в которой выделяется тепло, например реакция (1), называется экзотермической, а реакция, которая протекает только при подводе тепла извне, например реакция (2), - эндотермической. Почти все химические реакции сопровождаются выделением или поглощением тепла, но в уравнениях это часто не указывают, если только не рассматриваются термодинамические аспекты процесса.
Реакции замещения
 <="" div="" style="border-style: none;">
<="" div="" style="border-style: none;">
или
 <="" div="" style="border-style: none;">
<="" div="" style="border-style: none;">
Примеры:
 <="" div="" style="border-style: none;">
<="" div="" style="border-style: none;">
В реакции (4) металлический цинк замещает водород в соляной кислоте. В реакции (5) медь замещает серебро в нитрате серебра. В реакции (6) хлор замещает бром в бромиде кальция. Реакции обмена (двойного замещения) XY + UV (r) XV + UY Примеры:
 <="" div="" style="border-style: none;">
<="" div="" style="border-style: none;">
Реакция (7) - типичный пример кислотно-основной реакции (реакции нейтрализации), продуктами которой являются соль и вода. В реакции (8) в результате взаимодействия иона бария Ba2+, принадлежащего нитрату бария Ba(NO3)2, c сульфат-ионом
 <="" div="" style="border-style: none;">
<="" div="" style="border-style: none;">
серной кислоты образуется осадок сульфата бария BaSO4. В реакциях (7) и (8) реагирующие вещества обмениваются катионами.
Реакции разложения (расщепления)
 <="" div="" style="border-style: none;">
<="" div="" style="border-style: none;">
Примеры
 <="" div="" style="border-style: none;">
<="" div="" style="border-style: none;">
В реакции (9) синие кристаллы гидратированного сульфата меди разлагаются при нагревании, при этом гидратная вода превращается в пар. Реакция (10) протекает при относительно невысокой температуре в присутствии катализатора - диоксида марганца. Катализатор ускоряет химическую реакцию, оставаясь при этом неизменным (см. также КАТАЛИЗ). Реакция (11) применяется в промышленности: известняк (карбонат кальция CaCO3) при интенсивном нагревании разлагается, образуя негашеную известь (оксид кальция CaO) - важную составную часть цемента.
Обратимые реакции

Стрелки в прямом и обратном направлениях указывают, что продукты реакции взаимодействуют с образованием исходных реагентов, другими словами, реакция идет в обоих направлениях. Систему, в которой протекает обратимая реакция, можно уподобить двум водоемам, соединенным узкой протокой, в которых обитают два или несколько видов рыб. Рыбы беспрепятственно переплывают из одного водоема в другой, так что в конце концов каждый водоем оказывается заселенным смешанной популяцией постоянного состава. Это и есть состояние равновесия. Примеры:">
или

Стрелки в прямом и обратном направлениях указывают, что продукты реакции взаимодействуют с образованием исходных реагентов, другими словами, реакция идет в обоих направлениях. Систему, в которой протекает обратимая реакция, можно уподобить двум водоемам, соединенным узкой протокой, в которых обитают два или несколько видов рыб. Рыбы беспрепятственно переплывают из одного водоема в другой, так что в конце концов каждый водоем оказывается заселенным смешанной популяцией постоянного состава. Это и есть состояние равновесия. Примеры:
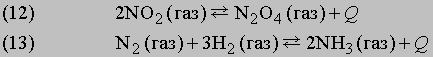 <="" div="" style="border-style: none;">
<="" div="" style="border-style: none;">
Количества исходных веществ и продуктов реакции сильно зависят от давления, температуры и концентрации реагирующих веществ.
Ионные реакции. Химические уравнения можно записывать с указанием заряда исходных веществ и продуктов реакции (+, -, 0 означают положительный, отрицательный и нулевой электрические заряды соответственно; их помещают вверху справа от символа химического элемента). Члены уравнения в правой и левой его частях, отвечающие группам атомов одинакового состава, несущих одинаковый заряд, можно сокращать, как это принято в алгебраических уравнениях:
 <="" div="" style="border-style: none;">
<="" div="" style="border-style: none;">
Ион серебра Ag+ несет один положительный заряд; следовательно, на каждый атом меди, образующий двухзарядный положительный ион, должно приходиться два иона серебра, поскольку суммы зарядов в левой и правой частях уравнений должны быть одинаковы. После сокращения одинаковых членов в обеих частях уравнения получаем уравнение (16), которое выражает химические превращения, произошедшие в реакции. Приведенные выше уравнения - это три разных способа представления одной и той же химической реакции: ее молекулярная форма, полная и сокращенная ионные формы.
Ядерные реакции. Ядерные реакции можно отнести к химическим лишь весьма условно, поскольку в них элемент превращается в изотоп того же элемента или другой элемент. Иногда какая-то часть вещества в ядерной реакции исчезает, и этот процесс сопровождается высвобождением огромного количества энергии; такие процессы происходят при взрыве атомной бомбы или в ядерном реакторе. Обычно в уравнениях ядерных реакций фигурируют нейтроны (

). Верхний левый индекс обозначает массу частицы, а нижний левый - ее заряд. Приведем уравнения типичных ядерных реакций:>>>>">
) и позитроны (

). Верхний левый индекс обозначает массу частицы, а нижний левый - ее заряд. Приведем уравнения типичных ядерных реакций:>>>">
), g-лучи (

) и позитроны (

). Верхний левый индекс обозначает массу частицы, а нижний левый - ее заряд. Приведем уравнения типичных ядерных реакций:>>">
), a-частицы (

), g-лучи (

) и позитроны (

). Верхний левый индекс обозначает массу частицы, а нижний левый - ее заряд. Приведем уравнения типичных ядерных реакций:>">
), электроны (

), a-частицы (

), g-лучи (

) и позитроны (

). Верхний левый индекс обозначает массу частицы, а нижний левый - ее заряд. Приведем уравнения типичных ядерных реакций:">
), протоны (

), электроны (

), a-частицы (

), g-лучи (

) и позитроны (

). Верхний левый индекс обозначает массу частицы, а нижний левый - ее заряд. Приведем уравнения типичных ядерных реакций:
 <="" div="" style="border-style: none;">
<="" div="" style="border-style: none;">
Суммы верхних индексов в левой и правой частях уравнения должны быть одинаковыми; то же самое относится к нижним индексам. Может показаться, что масса вещества в ходе ядерных реакций (17)-(19) не изменяется. В действительности же вследствие взаимодействия элементарных частиц в ядре и изменения их массы покоя у продуктов масса может оказаться чуть меньше, чем у исходных веществ. Именно с исчезновением этого незначительного количества вещества, которое превращается в энергию согласно уравнению Эйнштейна Е = mc2, и связана разрушительная сила ядерного взрыва. Протекающая при этом реакция описывается уравнением (19). В уравнении (17) (

) ((криптон) испускает нейтрон с образованием изотопа с тем же атомным номером (36), но массой, меньшей на единицу.
Окислительно-восстановительные реакции. В ходе окислительно-восстановительной реакции меняется заряд элементов (их степень окисления), что и учитывается при написании уравнения. Потеря электрона называется окислением, а приобретение - восстановлением. Число отданных и приобретенных в ходе реакции электронов должно быть одинаковым, и исходя из этого устанавливаются соотношения между всеми участниками реакции. Рассмотрим реакцию
 <="" div="" style="border-style: none;">
<="" div="" style="border-style: none;">
Приведем более сложный пример - окислительно-восстановительную реакцию между медью и концентрированной азотной кислотой:
 <="" div="" style="border-style: none;">
<="" div="" style="border-style: none;">
В ходе этой реакции Сu0 теряет 2 электрона, превращаясь в ион Сu2+, а N5+ принимает 1 электрон, превращаясь в N4+. Чтобы уравнять число отданных электронов с числом приобретенных, вводим коэффициент 2 перед NO2 в правой части, а чтобы число атомов азота при этом осталось прежним, умножаем HNO3 в левой части на 2. Cu(NO3)2 в правой части содержит два иона степень окисления N в которых равна +5. Чтобы сохранить число ионов в левой части с той же степенью окисления, добавляем в левой части 2 молекулы HNO3. Далее, чтобы уравнять 4H+, содержащихся в молекулах HNO3, записываем в правой части 2H2O. В левой части имеем 3*4 = 12 ионов кислорода, содержащихся в кислоте. Эти 12 ионов кислорода присутствуют и в правой части: 2 в воде, 4 в NO2 и 6 в нитрате меди Cu(NO3)2. Аналогичным образом можно записывать любые, более сложные уравнения.
Применение. Химические уравнения используются химиками-технологами при расчете характеристик производственных процессов. Так, с их помощью определяется количество реагентов (сырья), необходимое для получения данного количества продукта.






