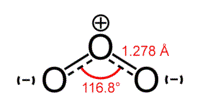
Кислород образует две аллотропные модификации: кислород O2 и озон O3.
Озон O3 — бесцветный газ с характерным запахом, растворяется в воде лучше, чем кислород. Озон — токсичное вещество. Его получают из кислорода пропусканием тлеющего электрического разряда через кислород:
3O2 = 2O3
Озон — нестабильное вещество и самопроизвольно превращается в кислород:
2O3 = 3O2
O3 проявляет в реакциях сильные окислительные свойства, выраженные ярче, чем у кислорода. Молекула О3 неустойчива и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно за несколько десятков минут[5] превращается в O2 с выделением тепла. Повышение температуры и понижение давления увеличивают скорость перехода в двухатомное состояние. При больших концентрациях переход может носить взрывной характер. Контакт озона даже с малыми количествами органических веществ, некоторых металлов или их окислов резко ускоряет превращение.
В присутствии небольших количеств HNO3 озон стабилизируется, а в герметичных сосудах из стекла, некоторых пластмасс или чистых металлов озон при низких температурах (—78 °С) практически не разлагается.
Озон — мощный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины и иридия) до их высших степеней окисления. Окисляет многие неметаллы. Продуктом реакции в основном является кислород.
2 Cu2+(aq) + 2 H3O+(aq) + O3(g) → 2 Cu3+(aq) + 3 H2O(l) + O2(g)
Озон повышает степень окисления оксидов:
NO + O3 → NO2 + O2
Эта реакция сопровождается хемилюминесценцией. Двуокись азота может быть окислена до трёхокиси азота:
NO2 + O3 → NO3 + O2
с образованием азотного ангидрида N2O5:
NO2 + NO3 → N2O5
Озон реагирует с углеродом при нормальной температуре с образованием двуокиси углерода:
C + 2 O3 → CO2 + 2 O2
Озон не реагирует с аммониевыми солями, но реагирует с аммиаком с образованием нитрата аммония:
2 NH3 + 4 O3 → NH4NO3 + 4 O2 + H2O
Озон реагирует с водородом с образованием воды и кислорода:
O3 + H2 → H2O + O2
Озон реагирует с сульфидами с образованием сульфатов:
PbS + 2O3 → PbSO4 + O2
С помощью озона можно получить Серную кислоту как из элементарной серы, так и из двуокиси серы:
S + H2O + O3 → H2SO4
3 SO2 + 3 H2O + O3 → 3 H2SO4
Все три атома кислорода в озоне могут реагировать по отдельности в реакции хлорида олова с соляной кислотой и озоном:
3 SnCl2 + 6 HCl + O3 → 3 SnCl4 + 3 H2O
В газовой фазе озон взаимодействует с сероводородом с образованием двуокиси серы:
H2S + O3 → SO2 + H2O
В водном растворе проходят две конкурирующие реакции с сероводородом, одна с образованием элементарной серы, другая с образованием серной кислоты:
H2S + O3 → S + O2 + H2O
3 H2S + 4 O3 → 3 H2SO4
Обработкой озоном раствора йода в холодной безводной хлорной кислоте может быть получен перхлорат йода (III):
I2 + 6 HClO4 + O3 → 2 I(ClO4)3 + 3 H2O
Твёрдый нитрилперхлорат может быть получен реакцией газообразных NO2, ClO2 и O3:
2 NO2 + 2 ClO2 + 2 O3 → 2 NO2ClO4 + O2
Озон может участвовать в реакциях горения, при этом температуры горения выше, чем с двухатомным кислородом:
3 C4N2 + 4 O3 → 12 CO + 3 N2
Озон может реагировать при низких температурах. При 77 K (-196 °C), атомарный водород взаимодействует с озоном с образованием супероксидного радикала с димеризацией последнего[6]:
H + O3 → HO2 + O
2 HO2 → H2O2+O2
Озон может образовывать озониды, содержащие анион O3−. Эти соединения взрывоопасны и могут храниться при низких температурах. Известны озониды всех щелочных металлов. KO3, RbO3, и CsO3 могут быть получены из соответствующих супероксидов:
KO2 + O3 → KO3 + O2
Озонид калия может быть получен и другим путём из гидроокиси калия[7]:
2 KOH + 5 O3 → 2 KO3 + 5 O2 + H2O
NaO3 и LiO3 могут быть получены действием CsO3 в жидком аммиаке NH3 на ионообменные смолы, содержащие ионы Na+ или Li+[8]:
CsO3 + Na+ → Cs+ + NaO3
Обработка озоном раствора кальция в аммиаке приводит к образованию озонида аммония, а не кальция[6]:
3 Ca + 10 NH3 + 6 O3 → Ca•6NH3 + Ca(OH)2 + Ca(NO3)2 + 2 NH4O3 + 2 O2 + H2
Озон может быть использован для удаления марганца из воды с образованием осадка, который может быть удалён фильтрованием:
2 Mn2+ + 2 O3 + 4 H2O → 2 MnO(OH)2 (s) + 2 O2 + 4 H+
Озон превращает цианиды во много раз менее токсичные цианаты:
CN− + O3 → CNO− + O2
Озон может полностью разлагать мочевину[9]:
(NH2)2CO + O3 → N2+ CO2 + 2 H2O






