о садок растворяется, если гетерогенное равновесие смещается вправо, при этом насыщенный раствор переходит в ненасыщенный путем связывания одного из ионов труднорастворимого электролита в более прочные частицы:
· слабый электролит;
· менее растворимое вещество, ПР которого меньше;
· газ;
· комплексный ион.
Кроме того, на растворение осадков влияет температура. С ростом температуры возрастает и величина ПР. Раствор оказывается ненасыщенным (при высокой температуре), т.е. выполняется неравенство ПР > ПК.
Пример 1. Объяснить с точки зрения теории ПР, почему гидроксид меди (I) растворяется при добавлении аммиака?
Ионы  образуют аммиачные комплексы общей формулы
образуют аммиачные комплексы общей формулы  , где n – заряд иона.
, где n – заряд иона.
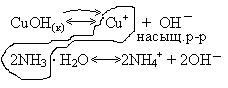 |
Схема поведения осадка:
Ионы  и молекулы
и молекулы  образуют комплексный ион:
образуют комплексный ион:  .
.
Запишем уравнение реакции:

Ионы насыщенного раствора связываются в прочные комплексные соединения, гетерогенное равновесие смещается вправо. Осадок CuOH растворяется в аммиаке.
Пример 2. Будет ли гидроксид алюминия растворяться в минеральных кислотах и щелочах?
Амфотерные гидроксиды металлов, такие как 
 и др., растворяются в щелочах (ЭОН) с образованием гидрокомплексов общей формулы
и др., растворяются в щелочах (ЭОН) с образованием гидрокомплексов общей формулы  , где n – заряд иона металла, соединения которого амфотерны;
, где n – заряд иона металла, соединения которого амфотерны;  - ион металла образующего щелочь (например,
- ион металла образующего щелочь (например,  ).
).  будет растворяться в щелочах, например, в NaOH.
будет растворяться в щелочах, например, в NaOH.
 Схема поведения осадка:
Схема поведения осадка:
Ионы  и
и  образуют комплексный ион
образуют комплексный ион 
Запишем уравнение реакции:
 .
.
Ионы насыщенного раствора связываются в прочное комплексное соединение, гетерогенное равновесие смещается вправо. Осадок  растворяется в щелочи.
растворяется в щелочи.
 будет растворяться в минеральных (неорганических) кислотах, например, в НС1.
будет растворяться в минеральных (неорганических) кислотах, например, в НС1.
Схема поведения осадка: 
Уравнение реакции: А1(ОН)3 + 3НС1 → А1С13 + 3Н2О.
Ионы насыщенного раствора связываются с образованием слабого электролита – воды, гетерогенное равновесие смещается вправо. Осадок А1(ОН)3 растворяется в соляной кислоте.
Пример 3. Объяснить причину растворения хлорида свинца (П) в растворе иодида калия.
 Схема поведения осадка:
Схема поведения осадка:
PbJ2 – малорастворимое соединение. Осадок PbCl2 будет растворяться, если при этом образуется еще менее растворимый осадок, ПР которого меньше. Воспользуемся справочными данными (приложение таблица 5):  . PbJ2 менее растворимое вещество. Уравнение реакции:
. PbJ2 менее растворимое вещество. Уравнение реакции:
PbCl2(к) + 2KJ → PbJ2(к) + 2KC1
бел.осадок желт.осадок
ионы насыщенного раствора связываются с образованием малорастворимого соединения, ПР которого меньше, гетерогенное равновесие смещается вправо. Осадок PbCl2 переходит в осадок PbJ2.
Пример 4. Будет ли растворяться осадок оксалата кальция СаС2О4 а) в соляной НС1 и б) в уксусной СН3СООН кислотах?
а) Схема поведения осадка:

Щавелевая кислота – слабый электролит. Константа ионизации по 1 ступени – 5,9×10-2.
Уравнение реакции: СаС2О4 + 2НС1 → СаС12 + Н2С2О4.
Ионы насыщенного раствора связываются в молекул слабого электролита щавелевой кислоты Н2С2О4, гетерогенное равновесие смещается вправо. осадок СаС2О4 растворяется в соляной кислоте.
б) Схема поведения осадка:
СаС2О4(к) ↔ Са2+ + С2О42-
насыщ.р-р
СН3СООН ↔ СН3СОО- + Н+.
Осадок будет растворяться, если образуется более слабый электролит. Оценить силу электролита можно с помощью константы ионизации. Выпишем из приложения константы ионизации (таблица 3):

Уксусная кислота более слабая. Она не может вытеснить более сильную щавелевую кислоту из ее соли. Гетерогенное равновесие не нарушается, осадок СаС2О4 в уксусной кислоте не растворяется.






