1. При диссоциации сильных электролитов ставится знак «=» (равенства) или «®» (одна стрелочка). Этот знак обозначает полную диссоциацию.
2. При диссоциации слабых (и средней силы) электролитов – знак «Û» (обратимости). Этот знак обозначает частичную диссоциацию.
Правила написания ионных уравнений
В ионных уравнениях на ионы расписываются:
1. сильные кислоты;
2. щелочи;
3. растворимые соли.
| Сильные электролиты | Слабые электролиты |
 Основания:
Са(OH)2 = Ca2+ + 2OH-
Кислоты:
HCl = H++Cl-
Соли:
Na2CO3=2Na++CO32-
KH2PO4=K++H2PO4-
анион слабой
кислоты
H2PO4-ÛH++HPO42-
HPO42-ÛH++PO43-
AlOHCl2ÛAlOHCl2 = AlOH2++2Cl-
осадок растворимая катион слабого
часть основания
AlOH2+ÛAl3++OH- Основания:
Са(OH)2 = Ca2+ + 2OH-
Кислоты:
HCl = H++Cl-
Соли:
Na2CO3=2Na++CO32-
KH2PO4=K++H2PO4-
анион слабой
кислоты
H2PO4-ÛH++HPO42-
HPO42-ÛH++PO43-
AlOHCl2ÛAlOHCl2 = AlOH2++2Cl-
осадок растворимая катион слабого
часть основания
AlOH2+ÛAl3++OH-
| Основания:
Fe(OH)2 ÛFeOH+ + OH- 1 ступень
FeOH+ÛFe2++OH- 2 ступень
Кислоты:
H2CO3ÛH++HCO3- I ступень
HCO3-ÛH++CO32- II ступень
Амфотерные гидроксиды:
1.  Zn(OH)2ÛZnOH++OH- по осн.
ZnOH+ÛZn2++OH- типу
2. H2ZnO2ÛH++HZnO2- по кисл.
HZnO2-ÛH++ZnO22- типу
Вода:
H2OÛH++OH- Zn(OH)2ÛZnOH++OH- по осн.
ZnOH+ÛZn2++OH- типу
2. H2ZnO2ÛH++HZnO2- по кисл.
HZnO2-ÛH++ZnO22- типу
Вода:
H2OÛH++OH-
|
КОНЦЕНТРАЦИЯ РАСТВОРОВ
Важнейшей характеристикой количественного содержания компонентов в системе является концентрация растворов.
Концентрацией растворов называют определенное массовое (или объемное) содержание растворенного вещества в определенном массовом (или объемном) количестве растворителя или раствора.
Существуют несколько методов выражения концентрации растворов. Рассмотрим самые распространенные из них:
| Методы выражения концентрации растворов | Обозначение и размерность применяемых величин |
Массовая доля растворенного вещества – это отношение массы растворенного вещества к общей массе раствора:
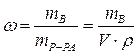
| 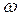 - массовая доля растворенного вещества, безразмерная величина - массовая доля растворенного вещества, безразмерная величина
|
| mВ - масса растворенного вещества, г | |
| mР-РА - масса раствора, г | |
| V - объем раствора, мл | |
| ρ -плотность раствора, г/мл | |
Процентная концентрация:
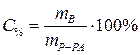
| С% - процентная концентрация, % |
| m В - масса растворенного вещества, г | |
| mР-РА - масса раствора, г | |
Молярная концентрация, или молярность, – число молей растворенного вещества в 1 дм3
(1 литр) раствора:
 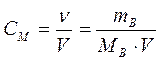
| СМ - молярная концентрация, или молярность; иногда обозначают М |
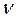 - количество (число моль) растворенного вещества, моль - количество (число моль) растворенного вещества, моль
| |
| V - объем раствора, дм3 (л) | |
| mВ - масса растворенного вещества, г | |
| МВ - молярная масса растворенного вещества, г/моль |
При решении задач необходимо обращать особое внимание на размерность применяемых величин и обязательно приводить их в соответствие друг другу. Поэтому при подстановке численных значений в формулы надо указывать размерность величин. Решение задач оформлять обязательно в соответствии с приведенными примерами (см. стр. 67 – 71).
ГИДРОЛИЗ СОЛЕЙ
Гидролиз – это процесс взаимодействия соли с водой, в результате которого происходит смещение ионного равновесия воды и изменение значения рН раствора. Возможность и характер протекания гидролиза определяется природой основания и кислоты, образующих соль.
Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются. Их водные растворы нейтральны.
KNO3+H2O ¹; pH=7.
В гидролизе участвуют ионы слабого основания и/или слабой кислоты.
· Гидролиз солей, образованных сильной кислотой и слабым основанием, например, NH4Cl:
NH4Cl = NH4++Cl -
Гидролизу подвергается катион слабого основания NH4+:
NH4+ + HOH Û NH4OH + H+ (ионы H+ в избытке).
Молекулярное уравнение:
NH4Cl + H2O Û NH4OH + HCl – кислая среда (рН < 7).
· Гидролиз солей, образованных слабой кислотой и сильным основанием, например: Na2SO3:
Na2SO3 = 2Na+ + SO32 -
Гидролизу подвергается анион слабой кислоты SO32 -:
1-я ступень: SO32 - +HOH Û HSO3 - +OH - (ионы OH - в избытке).
Молекулярное уравнение 1-й ступени:
Na2SO3 + H2O Û NaHSO3 + NaOH – щелочная среда (рН > 7).
При обычных условиях гидролиз протекает главным образом по первой ступени.
· Гидролиз солей образованных слабым основанием и слабой кислотой ((NH4)2CO3, Al2S3 и т.д.), гидролизуются как по катиону, так и по аниону. В этом случае гидролиз соли протекает до конца: в уравнении происходит замена знака “Û” на “=”, а рН среды определяется силой кислоты и основания:
NH4ClO = NH4+ + ClO -
NH4+ + ClO - + HOH = NH4OH + HClO
NH4ClO + H2O = NH4OH + HClO
K (HClO) = 3×10-8 < K (NH4OH) = 1,8×10-5, так как основание является более сильным электролитом, чем кислота, среда слабощелочная рН > 7.
· Совместный гидролиз двух солей Если в растворе одновременно присутствуют ионы, связывающие Н+ и ОН-, то в соответствии с принципом Ле Шателье равновесие смещается в сторону усиления процесса гидролиза. Гидролиз может протекать необратимо с образованием малорастворимого и газообразного веществ.
В качестве примера можно рассмотреть совместный гидролиз следующих солей:
Al 2(SO4)3 + K2 S + H2O ®
2Al3+ + 3S2 - + 6H2O = 2Al(OH)3 + 3H2S
Al2(SO4)3 + 3K2S + 6H2O = 2Al(OH)3¯ + 3H2S + 3К2SO4
pH» 7
7.ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
РЕАКЦИИ (ОВР)
Окислительно-восстановительными называются реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ. Например:
+4 -1 +2 0
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O






