Растворимость твердых веществ в определенных жидких растворителях- важная характеристика индивидуальных свойств вещества. Количественно растворимость характеризуется составом (концентрацией) насыщенного раствора. Насыщенный раствор - такой, в котором при данной температуре вещество растворяться уже не может.
Различают вещества растворимые и малорастворимые. К малорастворимым в воде относятся вещества, растворимость которых не превышает 10–2 моль/л.
Насыщенные растворы малорастворимых веществ - электролитов очень разбавлены. Та часть электролита, которая растворилась, находится в растворе в виде ионов. Между твердой фазой [AmBn] и ионами{A n+ }, {B m- } в растворе устанавливается равновесие растворимости. В общем виде это равновесие можно записать так:
[A m B n ] + aq ⇄ m {A n+ } + n {B m -}.
Применение закона действующих масс к гетерогенной системе – насыщенному раствору малорастворимого электролита, находящегося в равновесии со своим осадком дает выражение константы равновесия, которая и называется произведением растворимости (ПР):
 .
.
Таким образом, в насыщенном растворе малорастворимого электролита произведение концентраций его ионов в степенях, соответствующих стехиометрическимкоэффициентам при данных ионах, при данной температуре, – величина постоянная. Произведение растворимости малорастворимого электролита (ПР), как всякая константа равновесия, зависит только от природы электролита и температуры.
Зная ПР малорастворимого электролита, можно вычислить его растворимость S (моль/л, г/л или г/100 мл раствора).
Произведение растворимости характеризует сравнительную растворимость однотипных веществ: чем больше ПР данного вещества, тем больше его растворимость.
Если произведение концентраций ионов в растворе  малорастворимого электролита меньше ПР, то осадок не образуется, в этом случае раствор является ненасыщенным. Если ПС = ПР, раствор становится насыщенным по отношению к данному малорастворимому соединению. Образование осадка происходит в том случае, когда произведение концентраций ионов в растворе больше ПР, т. е. условие образования осадка следующее
малорастворимого электролита меньше ПР, то осадок не образуется, в этом случае раствор является ненасыщенным. Если ПС = ПР, раствор становится насыщенным по отношению к данному малорастворимому соединению. Образование осадка происходит в том случае, когда произведение концентраций ионов в растворе больше ПР, т. е. условие образования осадка следующее

Растворимость малорастворимого электролита уменьшается, если его раствор содержит хорошо растворимый электролит, имеющий одноименный ион, согласно принципу Ле-Шателье. Исключение составляют случаи образования комплексных соединений.
Пример 1. Рассчитайте концентрацию ионов серебра и сульфид-ионов в насыщенном растворе сульфида серебра.  .
.
Решение. В насыщенном растворе  устанавливается равновесие:
устанавливается равновесие:
[Ag2S]«2{Ag+}+{S2-}
Из уравнения следует, что в растворе концентрация ионов Ag+ в 2 раза больше, чем ионов S2–.
 . Тогда, если
. Тогда, если  , то
, то 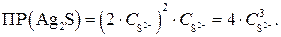
Выражаем концентрацию ионов S2–:
 моль/л,
моль/л,
тогда 
Пример 2. Растворимость сульфата кальция при 25оС равна 0,955 г/л. Определите величину 
Решение. Записываем уравнение равновесия, устанавливающегося в растворе CaSO4:
[CaSO4]«{Ca2+} +{SO42-}
тогда  .
.
Из уравнения диссоциации видно, что
 (где S – растворимость CaSO4, моль/л).
(где S – растворимость CaSO4, моль/л).
Выразим растворимость соли в молях на литр:
 ,
,
где M (CaSO4) – молярная масса CaSO4, г/моль.
Тогда  .
.
Пример 3. Будет ли выпадать осадок при смешивании равных объемов раствора нитрата серебра, молярная концентрация которого составляет 0,01 моль/л (0,01 M), и раствора хромата калия, молярная концентрация эквивалента которого равна 0,02 моль/л (0,02 н.)?  .
.
Решение. При сливании растворов нитрата серебра и хромата калия в осадок может выпасть труднорастворимый хромат серебра:
 ,
,
В ионно-молекулярной форме:

Условие образования осадка следующее

Чтобы рассчитать ПС, надо найти концентрации ионов серебра и хромат-ионов в растворе при смешивании. Но сначала вычисляем молярные концентрации интересующих нас ионов в исходных растворах.
Ионы серебра в растворе появляются при электролитической диссоциации AgNO3:

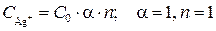 ,
,
тогда  моль/л.
моль/л.
Хромат-ионы появляются в растворе при электролитической диссоциации K2CrO4:

 ,
,
тогда  моль/л.
моль/л.
При сливании растворов объем раствора увеличивается, при этом концентрация каждого вещества уменьшается во столько раз, во сколько раз увеличится объем раствора. В данном случае при сливании равных объемов растворов объем общего раствора увеличивается в 2 раза, т. е. концентрация каждого раствора и соответственно концентрации ионов, участвующих в образовании хромата серебра, уменьшаются в 2 раза.
При смешивании растворов

 моль/л;
моль/л;
 моль/л.
моль/л.
Находим произведение концентраций ионов:
 .
.
Видно, что ПС = 1,25 ∙ 10–7 > ПР = 1,12 ∙ 10–12, следовательно осадок Ag2CrO4 будет выпадать.
ГИДРОЛИЗ СОЛЕЙ
Обменное взаимодействие соли с водой, приводящее к образованию слабого электролита, называется гидролизом солей.
Гидролизу подвергаются растворимые соли, образованные:
– слабой кислотой и сильным основанием;
– слабым основанием и сильной кислотой;
– слабым основанием и слабой кислотой.
В водных растворах солей, образованных сильными основаниями и сильными кислотами, таких как NaCl, K2SO4, Ba(NO3)2 и др., происходит только распад соли на ионы, которые не образуют с ионами H+ и OH– воды малодиссоциированныхчастиц, поэтому эти соли не подвергаются гидролизу, и, следовательно, pH растворов имеет ту же величину, что и pH воды.
В гидролизе участвуют катионы слабого основания и анионы слабой кислоты, в большинстве случаев гидролиз – процесс обратимый, протекает ступенчато. Гидролиз приводит к изменению pH среды. Уравнения реакций гидролиза составляют в молекулярной и ионно-молекулярной формах. Ниже приводятся примеры гидролиза солей.
Пример 1. Рассмотрим гидролиз раствора цианида калия. Соль KCN образована сильным основанием KOH и слабой кислотой HCN. В растворе соль диссоциирует:
KCN = K+ + CN–
Гидролизу подвергается анион слабой кислоты:
CN– + H2O D HCN + OH–
Учитывая, что в растворе присутствуют катионы калия (K+), получаем уравнение гидролиза в молекулярной форме:
KCN + H2O D HCN + KOH
В растворе накапливаются ионы OH–, следовательно, реакция среды щелочная, pH > 7.
Пример 2. Гидролиз раствора соли хлорида аммония:

NH4Cl = NH4+ + Cl– (диссоциация в растворе)
Гидролизу подвергается катион слабого основания:
NH4+ + H2O D NH4OH + H+
Поскольку в растворе присутствуют анионы Cl–, уравнение гидролиза в молекулярной форме имеет вид:
NH4Cl + H2O D NH4OH + HCl
В растворе накапливаются ионы H+, следовательно, реакция среды кислая, pH < 7.
Пример 3. Гидролиз раствора соли ацетата аммония:

CH3COONH4 = CH3COO– + NH4+ (диссоциация в растворе)
Гидролизу подвергаются катионы слабого основания и анионы слабой кислоты:
NH4+ + CH3СOO– + H2O D NH4OH + CH3СOOH
Уравнение гидролиза в молекулярной форме имеет вид:
CH3СOONH4 + H2O D CH3COOH + NH4OH.
Образуется два слабых электролита, реакция среды будет близка к нейтральной, pH ≈ 7.
Пример 4. Гидролиз раствора сульфата цинка:

ZnSO4 = Zn2+ + SO42– (диссоциация в растворе).
Гидролизу подвергается катион слабого основания:
Zn2+ + H2O DZnOH+ + H+ (I ступень)
В данном случае катион многозарядный (2+), поэтому гидролиз протекает ступенчато, причем преимущественно гидролиз ZnSO4 проходит по первой ступени, так как образуется наиболее устойчивая в водном растворе форма (ZnOH+). Учитывая, что в растворе присутствуют анионы SO42–, получаем уравнение гидролиза в молекулярной форме:
2ZnSO4 + 2H2O D (ZnOH)2SO4 + H2SO4 (I ступень)
Вторая ступень гидролиза возможна, но она протекает незначительно, так как образуется более диссоциированная форма Zn(OH)2:
ZnOH+ + H2O D Zn(OH)2 + H+ (II ступень)
В молекулярной форме:
(ZnOH)2SO4 + 2H2O D 2Zn(OH)2 + H2SO4
В растворе ZnSO4 накапливаются ионы H+, следовательно, реакция среды кислая, pH < 7.
Пример 5. Гидролиз раствора карбоната натрия:
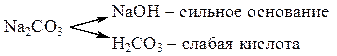
Na2CO3 = 2Na+ + CO3 2– (диссоциация в растворе)
Гидролизу подвергается многозарядный анион слабой кислоты:
CO32– + H2O D HCO3– + OH– (I ступень)
В молекулярной форме:
Na2CO3 + H2O D NaHCO3 + NaOH
Вторая ступень протекает незначительно, поэтому можем ограничиться рассмотрением первой ступени гидролиза.
В растворе Na2CO3 накапливаются ионы OH–, следовательно, реакция среды щелочная, pH > 7.
Пример 6. Гидролиз раствора сульфида алюминия:
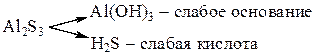
Гидролизу подвергаются катионы слабого основания и анионы слабой кислоты:

Образующиеся ионы H+ и OH– нейтрализуют друг друга, исчезновение этих ионов из сферы реакции в виде малодиссоциированной воды смещает оба равновесия вправо, что приводит к активизации следующей ступени гидролиза:

Из сказанного выше следует, что будет протекать и третья ступень гидролиза:

Суммарное ионно-молекулярное уравнение имеет вид:

или в молекулярной форме:
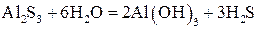 .
.
Сульфид алюминия в растворе полностью и необратимо гидролизуется с образованием нерастворимого гидроксида Al(OH)3 и слабой кислоты H2S.






