–≈Ў≈Ќ»≈:
ѕо таблице 11.1 находим значение стандартных электродных потенциалов железа и цинка:
 = - 0,44¬,
= - 0,44¬,  = - 0,76¬.
= - 0,76¬.
“ак как  <
<  , то анодом коррозионного гальванического элемента будет €вл€тьс€ цинк, катодом Ц железо.
, то анодом коррозионного гальванического элемента будет €вл€тьс€ цинк, катодом Ц железо.
а) оррози€ в атмосферных услови€х (H2O+O2).
—оставл€ем схему коррозионного √Ё:
 |  |
ј (-) Zn H2O + O2 Fe (+) K
—оставл€ем уравнени€ электродных процессов и суммарной реакции процесса коррозии:

 Ќќ ƒћ
Ќќ ƒћ
Ќа A(-) Zn Ц 2ē = Zn2+ 2
Ќа (+) 2H2O + O2 + 4ē = 4OH- 1
 |
2Zn + 2H2O + O2 = 2Zn(OH)2 Ц суммарное молекул€рное уравнение процесса коррозии.
б) оррози€ в кислой среде (H2SO4)
—оставл€ем схему коррозионного √Ё:
ј (-) Zn │ H2SO4 │ Fe (+) K
или
ј (-) Zn │ H+ │ Fe (+) K
—оставл€ем уравнени€ электродных процессов и суммарной реакции процесса коррозии:
Ќќ ƒћ

 Ќа A(-) Zn Ц 2ē = Zn2+ 1
Ќа A(-) Zn Ц 2ē = Zn2+ 1
Ќа (+) 2H+ + 2ē = H2 1
 |
Zn + 2H+ = Zn2+ + H2 - суммарное ионно-молекул€рное уравнение процесса коррозии;
Zn + H2SO4 = ZnSO4 + H2 Ц суммарное молекул€рное уравнение процесса коррозии.
в) оррози€ в кислой среде в присутствии кислорода (HCl+O2).
—оставл€ем схему коррозионного √Ё:
ј (-) Zn │ HCl + O2 │ Fe (+) K
или
ј (-) Zn │ H+ + O2 │ Fe (+) K
—оставл€ем уравнени€ электродных процессов и суммарной реакции процесса коррозии:

 Ќќ ƒћ
Ќќ ƒћ
Ќа A (-) Zn Ц 2ē = Zn2+ 2
 Ќа (+) 4H+ + O2 + 4ē = 2H2O 1
Ќа (+) 4H+ + O2 + 4ē = 2H2O 1
2Zn + 4H+ + O2 = 2Zn2+ + 2H2O Ц суммарное ионно-молекул€рное уравнение процесса коррозии
2Zn + 4HCl + O2 = 2ZnCl2 + 2H2O Ц суммарное молекул€рное уравнение процесса коррозии.
¬о всех случа€х коррозионному разрушению будет подвергатьс€ более активный металл Ц цинк.
”–ќ¬≈Ќ№ ¬
1. —оставить схему гальванического элемента (√Ё), образованного цинковым электродом, погруженным в 1ћ раствор хлорида цинка, и хромовым электродом, погруженным в 1·10-3ћ раствор хлорида хрома (III). –ассчитать напр€жение √Ё, написать уравнени€ электродных процессов и суммарной токообразующей реакции.

| –≈Ў≈Ќ»≈: ƒл€ составлени€ схемы √Ё необхо-димо знать величины электродных потенциалов металлов Ц цинка и хрома. ѕо таблице 11.1 определ€ем стан-дартные электродные потенциалы металлов: |
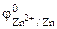 = - 0,76 ¬,
= - 0,76 ¬, 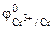 = - 0,74¬.
= - 0,74¬.
’лорид цинка диссоциирует по уравнению:
ZnCl2 = Zn2+ + 2—l-.
 =
= 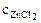 ∙α∙
∙α∙  = 1∙1∙1 = 1 моль/л,
= 1∙1∙1 = 1 моль/л,
α = 1 (ZnCl2 Ц сильный электролит),  = 1, поскольку услови€ стандартные
= 1, поскольку услови€ стандартные  = -0,76¬.
= -0,76¬.
’лорид хрома (III) диссоциирует по уравнению:
CrCl3 = Cr3+ + 3—l-
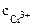 =
= 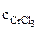 ∙α∙
∙α∙ 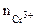 = 10-3∙1∙1 = 10-3 моль/л,
= 10-3∙1∙1 = 10-3 моль/л,
α = 1 (CrCl3 Ц сильный электролит), 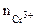 = 1, поскольку услови€ отличны от стандартных, рассчитываем электродный потенциал хрома:
= 1, поскольку услови€ отличны от стандартных, рассчитываем электродный потенциал хрома:
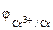 =
= 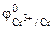 +
+ 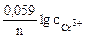 = -0,74 +
= -0,74 +  lg10-3= -0,80¬
lg10-3= -0,80¬
“ак как 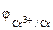 <
<  , то в √Ё анодом будет €вл€тьс€ хром, катодом Ц цинк.
, то в √Ё анодом будет €вл€тьс€ хром, катодом Ц цинк.
|
|
|
—оставл€ем схему √Ё:
ј (-) Cr │ CrCl3 ││ ZnCl2 │ Zn (+) K
ј (-) Cr │ Cr3+ ││ Zn2+ │ Zn (+) K
—оставл€ем уравнени€ электродных процессов и суммарной токообразующей реакции:

 Ќќ ƒћ
Ќќ ƒћ
Ќа A(-)Cr Ц 3ē = Cr3+ 2
Ќа (+)Zn2+ + 2ē = Zn 3

2Cr + 3Zn2+ = 2Cr3+ + 3Zn - суммарное ионно-молекул€рное уравнение токообразующей реакции
2Cr + 3ZnCl2 = 2CrCl3 + 3Zn - суммарное молекул€рное уравнение токообразующей реакции.
–ассчитываем напр€жение √Ё:
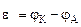 =
=  -
-  = -0,76-(-0,80)= 0,04¬
= -0,76-(-0,80)= 0,04¬
ќтвет: ε = 0,04¬.
2. —оставить схему √Ё, в котором протекает химическа€ реакци€ Fe + Ni2+ = Fe2+ + Ni. Ќаписать уравнени€ электродных процессов. Ќа основании стандартных значений энергий √иббса образовани€ ионов ∆fG0(298 , Men+) рассчитать стандартное напр€жение √Ё и константу равновеси€ реакции при 298 .
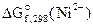 = - 64,4 кƒж/моль;
= - 64,4 кƒж/моль;
 = - 84,94 кƒж/моль.
= - 84,94 кƒж/моль.
ƒано:
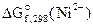 = -64,4 кƒж/моль = -64,4 кƒж/моль
 = -84,94 кƒж/моль
“ = 298 = -84,94 кƒж/моль
“ = 298
 ε0 -? с -?
ε0 -? с -?
| –≈Ў≈Ќ»≈: Ќа основании реакции, приведенной в условии задачи, составл€ем уравнени€ электродных процессов: |
Ќќ ƒћ

 Ќа A(-)Fe Ц 2ē = Fe2+ 1 - окисление
Ќа A(-)Fe Ц 2ē = Fe2+ 1 - окисление
Ќа (+)Ni2+ + 2ē = Ni 1 - восстановление
јнодом √Ё €вл€етс€ электрод, на котором происходит процесс окислени€. атодом Ц электрод, на котором происходит процесс восстановлени€. “огда в рассматриваемом √Ё анодом будет €вл€тьс€ железо, катодом Ц никель.
—оставл€ем схему √Ё:
ј(-) Fe │ Fe2+ ║ Ni2+ │ Ni(+)K
–ассчитываем стандартное напр€жение √Ё:
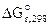 = - z∙F∙ε0,
= - z∙F∙ε0,
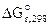 =
=  -
- 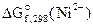 =
=
= -84,94-(-64,4) = -20,54 кƒж,
ε0 = 
z = 2, F = 96500 л/моль.
–ассчитываем константу равновеси€ токообразующей реакции ( c).
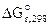 = - 2,303∙R∙T∙lgKc;
= - 2,303∙R∙T∙lgKc;
lgKс = 
Kс = 103,6 = 3981
ќтвет: ε0 = 0,106¬, Kс = 3981.
3. —оставить схему коррозионного √Ё, возникающего при контакте железной пластинки площадью 20 см2 с никелевой в растворе сол€ной кислоты HCl. Ќаписать уравнени€ электродных процессов и суммарной реакции процесса коррозии.
а) ¬ычислить объемный и весовой показатели коррозии, если за 40 минут в процессе коррозии выделилось 0,5 см3 газа (н.у.).
б) ¬ычислить весовой и глубинный показатели коррозии, если за 120 минут потер€ массы железной пластинки составила 3,7∙10-3 г. ѕлотность железа равна 7,9 г/см3.
–≈Ў≈Ќ»≈:
ѕо таблице 11.1 находим значени€ стандартных электродных потенциалов железа и никел€:
 = - 0,44¬,
= - 0,44¬, 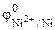 = - 0,26¬.
= - 0,26¬.
“ак как  <
< 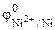 , то анодом коррозионного √Ё будет €вл€тьс€ железо, катодом Ц никель.
, то анодом коррозионного √Ё будет €вл€тьс€ железо, катодом Ц никель.
—оставим схему коррозионного √Ё:
ј (-) Fe │ HCl │ Ni (+) K
или
ј (-) Fe │ H+ │ Ni (+) K
Cоставл€ем уравнени€ электродных процессов и суммарной реакции процесса коррозии:
Ќа A Fe Ц 2ē = Fe2+
 Ќа 2Ќ+ + 2ē = Ќ2
Ќа 2Ќ+ + 2ē = Ќ2
Fe + 2H+ = Fe2+ + H2 Ц суммарное ионно-молекул€рное уравнение процесса коррозии.
Fe + 2HCl = FeCl2 + H2 Ц суммарное молекул€рное уравнение процесса коррозии.
а)

| –ассчитываем объемный показатель коррозии KV по формуле:
KV =  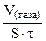 , см3/м2∙час.
ѕри расчете KV принимаем: S Ц [м2], τ - [час], V(газа) Ц [см3]. , см3/м2∙час.
ѕри расчете KV принимаем: S Ц [м2], τ - [час], V(газа) Ц [см3].
|
»з уравнени€ суммарной реакции процесса коррозии следует, что при коррозии выдел€етс€ водород.
|
|
|
—ледовательно, V(газа) =  .
.
“огда, KV = 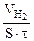 =
= 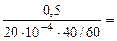 375 см3/м2∙час.
375 см3/м2∙час.
10-4 Ц коэффициент пересчета, см2 в м2.
–ассчитываем весовой показатель коррозии Km по формуле:
Km = 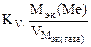 , г/м2∙час.
, г/м2∙час.
¬ процессе коррозии разрушению подвергаетс€ железо и выдел€етс€ водород.
—ледовательно:
ћэк(ће) = ћэк(Fe) =  =28 г/моль,
=28 г/моль,
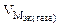
 = 11200 см3/моль.
= 11200 см3/моль.
Km =  = 0,94 г/м2∙час.
= 0,94 г/м2∙час.
ќтвет: KV = 375 см3/м2∙час, Km = 0,94 г/м2∙час.
б)

| –ассчитываем весовой показатель коррозии Km по формуле:
Km =  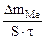 , г/м2∙час.
оррозии подвергаетс€ железо. “огда потер€ массы металла , г/м2∙час.
оррозии подвергаетс€ железо. “огда потер€ массы металла  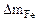 . .
|
ѕри расчете Km принимаем:  - [г]; S Ц [м2], τ - [час].
- [г]; S Ц [м2], τ - [час].
“огда: Km = 
 =
=  = 0,925 г/м2∙час.
= 0,925 г/м2∙час.
–ассчитываем глубинный показатель коррозии по формуле:
ѕ =  =
=  мм/год.
мм/год.
ќтвет: Km = 0,925 г/м2∙час, ѕ = 1,03 мм/год.
ЁЋ≈ “–ќЋ»« –ј—“¬ќ–ќ¬
“аблица 11.1. ѕроцессы протекающие на катоде при электролизе водных растворов
 ¬ ¬
| атио-ны в вод- ном рас- творе | «оны | ѕроцессы на катоде |
| -3,02 -2,99 -2,93 -2,92 -2,90 -2,89 -2,87 -2,71 -2,34 -1,67 | Li+, Rb+, Cs+ K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Al3+ | I | атионы этих металлов на катоде не восстанавли-ваютс€, а концентри-руютс€ в околокатодном пространстве (католите). Ќа катоде восстанавливаютс€ только молекулы воды: 2Ќ2ќ + 2ē = 2ќЌ- + Ќ2 |
| -1,05 -0,76 -0,74 -0,44 -0,40 -0,28 -0,26 -0,14 -0,13 | Mn2+, Zn2+, Cr3+, Fe2+, Cd2+, Co2+, Ni2+, Sn2+, Pb2+ | II |  Ќа катоде параллельно протекают два процесса:
ћеn+ + nē = Me
2Ќ2ќ + 2ē = 2ќЌ- + Ќ2 Ќа катоде параллельно протекают два процесса:
ћеn+ + nē = Me
2Ќ2ќ + 2ē = 2ќЌ- + Ќ2
|
| 0,00 | Ќ+ | ѕри электролизе кислоты 2Ќ+ + 2ē = Ќ2 | |
| +0,20 +0,23 +0,34 +0,80 +0,83 +0,85 +1,20 | Sb3+, Bi3+, Cu2+, Ag+, Pd2+, Hg2+, Pt2+ | III | ¬осстанавливаютс€ только ионы этих металлов ћеn+ + nē = Me |
“аблица 11.2. ѕоследовательность окислени€ анионов на инертном аноде в водном растворе.
| ќчередность окислени€ анионов | ѕроцессы окислени€ на аноде. |
| 1. | ќкисл€ютс€ анионы бескислородных кислот (Cl-, Br-, J-, S2-, и др.) Ќапример: 2Cl- -2ē = Cl2 |
| 2. | ќкисл€ютс€ ќЌ- ионы 4ќЌ- -4ē = ќ2 + 2Ќ2ќ |
≈сли в водном растворе присутствуют анионы кислородсодержащих кислот ( , ,  , , 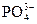 , и др.), то они на аноде не окисл€ютс€, а концентрируютс€ в околоанодном пространстве (анолите). Ќа аноде окиcл€ютс€ только молекулы воды.
2H2O - 4е = ќ2+4H+ , и др.), то они на аноде не окисл€ютс€, а концентрируютс€ в околоанодном пространстве (анолите). Ќа аноде окиcл€ютс€ только молекулы воды.
2H2O - 4е = ќ2+4H+
|
ѕримечание. ≈сли анод изготовлен из металлов II или III зоны (растворимый анод), то при электролизе протекает только процесс его растворени€ ћe0 Ц nē = Men+
”–ќ¬≈Ќ№ ј
1. —оставить схемы электролиза и написать уравнени€ электродных процессов водных растворов (анод инертный): а) хлорида меди (II), б) гидроксида натри€.
акие продукты выдел€ютс€ на катоде и аноде?

| –≈Ў≈Ќ»≈ а) CuCl2 = Cu2+ + 2Cl-, —хему электролиза составл€ем в соответствии с таблицами 11.1 и 11.2: K(-) A(+) инертный Cu2+ + 2ē = Cu 2Cl-- 2ē = Cl2 H2O H2O |
Ќа катоде выдел€етс€ Cu, на аноде выдел€етс€ Cl2.
б) NaќЌ = Na+ + ќЌ-
K(-) A(+) инертный
Na+ 4ќЌ  - 4ē = ќ2 + 2H2ќ
- 4ē = ќ2 + 2H2ќ
2H2O+2ē = H2+2OH-
Ќа катоде выдел€етс€ Ќ2, на аноде выдел€етс€ ќ2.
2.—оставить схемы электролиза и написать уравнени€ электродных процессов водного раствора сульфата никел€ (II), если: а) анод инертный, б) анод никелевый. акие продукты выдел€ютс€ на катоде и аноде?

| –≈Ў≈Ќ»≈
а) анод Ц инертный
NiSO4 = Ni2+ +  —хему электролиза составл€ем в соответствии с таблицами 11.1. и 11.2:
—хему электролиза составл€ем в соответствии с таблицами 11.1. и 11.2:
|
|
|
|
K(-) A(+) инертный
 Ni2+ + 2ē = Ni
Ni2+ + 2ē = Ni 
2H2O+2ē=H2+2OH- 2H2O-4ē=ќ2+4H+
Ќа катоде выдел€етс€ Ni и H2, на аноде выдел€етс€ ќ2.
б) анод Ц никелевый:
NiSO4 = Ni2+ + 
K(-) A(+) (Ni)
 Ni2+ + 2ē = Ni
Ni2+ + 2ē = Ni  , Ќ2ќ
, Ќ2ќ
2H2O+2ē = H2+2OH- Ni - 2ē = Ni2+
Ќа катоде выдел€етс€ Ni и H2, на аноде раствор€етс€ Ni.
3.ѕри электролизе растворов а) нитрата кальци€, б) нитрата серебра на аноде выдел€етс€ 560 мл газа (н.у.). —оставить схему электролиза и написать уравнени€ электродных процессов. ќпределить какое вещество и в каком количестве выделилось на катоде? јнод инертный.
|

| –≈Ў≈Ќ»≈
а) Ca(NO3)2 = Ca2+ + 2  —хема электролиза:
K(-) A(+) инертный
Ca2+
—хема электролиза:
K(-) A(+) инертный
Ca2+  2H2O+2ē=H2+2OH-
2H2O - 4ē = ќ2+4H+
Ќа катоде выдел€етс€ Ќ2, на аноде выдел€етс€ ќ2
ѕо закону эквивалентов: nэк (¬1)(анод) = nэк (¬2)(катод)
2H2O+2ē=H2+2OH-
2H2O - 4ē = ќ2+4H+
Ќа катоде выдел€етс€ Ќ2, на аноде выдел€етс€ ќ2
ѕо закону эквивалентов: nэк (¬1)(анод) = nэк (¬2)(катод)
|
¬ соответствии со схемой электролиза:
nэк (ќ2)(анод) = nэк (Ќ2)(катод) или 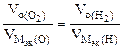 ,
,
откуда
 =
=  =
= 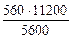 = 1120 см3,
= 1120 см3,
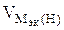 = 11200 см3/моль
= 11200 см3/моль
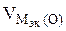 = 5600 см3/моль.
= 5600 см3/моль.
Ќа катоде выделилось 1120 см3 водорода.
ќтвет: 1120 см3 водорода.
б) AgNO3 = Ag+ + 
—хема электролиза:
K(-) A(+) инертный
Ag+ + ē = Ag 
H2O 2H2O-4ē=ќ2+4H+
Ќа катоде выдел€етс€ Ag, на аноде выдел€етс€ ќ2.
ѕо закону эквивалентов: nэк(Ag)(катод) = nэк(ќ2)(анод) или  , откуда
, откуда 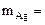
 =
=  = 10,8 г.
= 10,8 г.
где 
Ќа катоде выделилось 10,8 г серебра.
ќтвет: 10,8 г серебра.
”–ќ¬≈Ќ№ ¬
—оставить схему электролиза и написать уравнени€ электродных процессов водного раствора сульфата кали€ (анод инертный). ќпределить какие вещества и в каком количестве выдел€ютс€ на катоде и аноде, если проводить электролиз в течение четырех часов при силе тока 2ј. “емпература 298 , давление 99 кѕа.
ƒано:
Ёлектролит:
K2SO4
τ = 4 ч
“ = 298
I = 2 A
– = 99 кѕа
јнод инертный
 1. —хема электролиза-?
2.
1. —хема электролиза-?
2.  (катод) -?
3. (катод) -?
3.  (анод) -? (анод) -?
| –≈Ў≈Ќ»≈
K2SO4 = 2K+ + 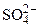 —хема электролиза:
K(-) A(+) (инертный)
K+
—хема электролиза:
K(-) A(+) (инертный)
K+  2H2O + 2ē = 2H2O - 4ē =
= H2 + 2OH- = ќ2 + 4H+
Ќа катоде выдел€етс€ H2, на аноде выдел€етс€ ќ2
ѕо закону ‘араде€ объемы водорода и кислорода, выделившиес€ при (н.у.):
2H2O + 2ē = 2H2O - 4ē =
= H2 + 2OH- = ќ2 + 4H+
Ќа катоде выдел€етс€ H2, на аноде выдел€етс€ ќ2
ѕо закону ‘араде€ объемы водорода и кислорода, выделившиес€ при (н.у.):
|
 =
=  = 3,34 л.
= 3,34 л.
где  = 11,2 л/моль.
= 11,2 л/моль.
F = 96500 л/моль, если τ Ц cек,
F = 26,8 ј∙ч/моль, если τ Ц час.
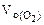 =
=  = 1,67 л,
= 1,67 л,
где 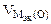 = 5,6 л/моль, т.е.
= 5,6 л/моль, т.е.  = 2
= 2 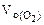
ќбъем водорода при заданных услови€х отличных от нормальных определ€ем из уравнени€:
 ,
,
откуда: 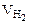 =
=  = 3,73 л
= 3,73 л
ќбъем кислорода при заданных услови€х:
 = 1/2
= 1/2 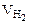 = 1,865 л.
= 1,865 л.
ќтвет: 3,73 л водорода, 1,865 л кислорода.
2.ћеталлическую деталь, площадь поверхности которой равна 100 см2, необходимо покрыть слоем электролитически осажденной меди из раствора хлорида меди (II). —оставить схему электролиза и написать уравнени€ электродных процессов, если анод медный. —колько времени должно длитьс€ осаждение при силе тока 8ј и выходе по току 98%, если толщина покрыти€ 0,15 мм. ѕлотность меди Ц 8,9 г/см3.
  ƒано:
Ёлектролит:
CuCl2
S = 100 см2
h = 0,15 мм
I = 8 A
BT = 98 %
ρCu = 8,9 г/см3 ƒано:
Ёлектролит:
CuCl2
S = 100 см2
h = 0,15 мм
I = 8 A
BT = 98 %
ρCu = 8,9 г/см3
 јнод медный
—хема электролиза-? јнод медный
—хема электролиза-?
 ¬рем€ электролиза, τ -? ¬рем€ электролиза, τ -?
|  –≈Ў≈Ќ»≈
CuCl2 = Cu2+ + 2Cl-
—хема электролиза:
K(-) A(+) (Cu)
Cu2+ + 2ē = Cu Cl-
H2O H2O
Cu Ц 2ē = Cu2+
Ќа катоде выдел€етс€ Cu, на аноде раствор€етс€ Cu.
¬“= –≈Ў≈Ќ»≈
CuCl2 = Cu2+ + 2Cl-
—хема электролиза:
K(-) A(+) (Cu)
Cu2+ + 2ē = Cu Cl-
H2O H2O
Cu Ц 2ē = Cu2+
Ќа катоде выдел€етс€ Cu, на аноде раствор€етс€ Cu.
¬“=  ;
mCu(факт) = mCu(теор)Ј¬“ ;
mCu(факт) = mCu(теор)Ј¬“
|
ѕо закону ‘араде€ с учетом выхода по току (¬“) масса меди, фактически выделившейс€ на катоде равна:
mCu(факт) =  .
.
ћасса меди, необходима€ дл€ получени€ медного покрыти€:
|
|
|
mCu(факт) = S∙h∙ρ (г), где S Ц см2, h Ц см, ρ Ц г/см3.
S∙h∙ρCu =  ,
,
откуда
τ = 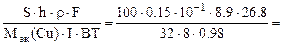 1,43 часа,
1,43 часа,
где Mэк(Cu) =  = 32 г/моль
= 32 г/моль
F = 26,8 Ц ј∙ч/моль,
10-1 Ц коэффициент пересчета мм в см.
ќтвет: 1,43 часа.
3.ќпределить мол€рную концентрацию эквивалента раствора нитрата серебра, если дл€ выделени€ всего серебра из 75 см3 этого раствора потребовалось пропустить ток силой 4ј в течение 25 минут. —оставить схему электролиза и написать уравнени€ электродных процессов. јнод инертный. ¬ыход по току серебра 100%.
   ƒано:
Ёлектролит: AgNO3
I = 4 A ƒано:
Ёлектролит: AgNO3
I = 4 A
 = 75 см3
τ = 25 мин
јнод инертный = 75 см3
τ = 25 мин
јнод инертный
 —хема электролиза-?
—хема электролиза-?
 -? -?
| –≈Ў≈Ќ»≈
AgNO3 = Ag+ +  —хема электролиза:
K(-) A(+) инертный
Ag+ + ē= Ag
—хема электролиза:
K(-) A(+) инертный
Ag+ + ē= Ag  H2O 2H2O - 4ē = ќ2 + 4H+
Ќа катоде выдел€етс€ Ag, на аноде выдел€етс€ ќ2.
H2O 2H2O - 4ē = ќ2 + 4H+
Ќа катоде выдел€етс€ Ag, на аноде выдел€етс€ ќ2.
|

ћол€рна€ концентраци€ эквивалента раствора AgNO3:
 =
= 
ѕо закону эквивалентов: nэк(AgNO3) = nэк(Ag),
nэк(Ag) =  ,
,
где mAg Ц масса серебра, выделившегос€ при электролизе с учетом 100 % выхода по току.
mAg = 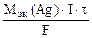 , откуда
, откуда
 =
= 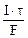 = nэк(Ag) = nэк(AgNO3)
= nэк(Ag) = nэк(AgNO3)
ћол€рна€ концентраци€ эквивалента раствора AgNO3:
 =
=  = 0,83 моль/л.
= 0,83 моль/л.
где τ Ц c, F Ц 96500 л/моль, Vр-ра Ц л.
60 Ц коэффициент пересчета мин. в сек.
10-3 Ц коэффициент пересчета см3 в л.
ќтвет:  = 0,83 моль/л.
= 0,83 моль/л.






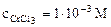 ε -?
ε -?
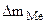 = 3,7·10-3 г.
S = 20 см 2
ρFe = 7,9 г/см3
Km -?
ѕ -?
= 3,7·10-3 г.
S = 20 см 2
ρFe = 7,9 г/см3
Km -?
ѕ -?
 = 560 см3
јнод инертный
1. —хема электролиза-?
2.
= 560 см3
јнод инертный
1. —хема электролиза-?
2.  -?
3.
-?
3.  -?
4.
-?
4.  -?
-?

