| Тип протолита, определение | Примеры протолитов: | ||
| молекулярных | катионных | анионных | |
| Кислота – донор Н+ | HCl | NH4+ | HSO4– |
| Основание – акцептор Н+ | NH3 | [Al(OH)(H2O)5]2+ | HPO42– |
| Амфолит – вещество, которое может быть и донором, и акцептором Н+ | H2O | [Al(OH)(H2O)5]2+ | H2PO4– |
Протолитическое равновесие – это взаимодействие кислоты и основания с образованием новой кислоты и нового основания. В нем может принимать участие растворитель-амфолит, например вода.
Сущность протолитического равновесия заключается в обратимом переносе протона Н+ от кислоты к основанию:

В протолитическом равновесии всегда участвуют две сопряженные кислотно-оснóвные пары. В приведенном примере пара 1 состоит из кислоты НА и сопряженного с ней основания А, пара 2 – из кислоты НВ и основания В.
Силу кислотных и оснóвных свойств отдельных компонентов сопряженной пары оценивают с помощью константы кислотности Kа и константы основности Kb.
Константа кислотности – это константа равновесия:
HA + H2O «H3O+ + A– Þ
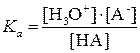
Константа основности – это константа равновесия:
B + H2O «BH+ + OH– Þ
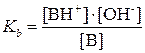
В водном растворе константы кислотности и основности сопряженной кислотно-оснóвной пары связаны между собой через константу автопротолиза воды KW:
Ka · Kb = KW (3.1)
Константа автопротолиза воды KW = 10–14, она характеризует равновесие автопротолиза воды:
H2O + H2O «H3O+ + OH–
Если прологарифмировать формулу (3.1) с обратным знаком, то получим удобное для использования выражение:
рKa + рKb = 14, (3.2)
где рKa = –lg Ka, рKb = –lg Kb
Таким образом, чем сильнее кислота, тем слабее сопряженное с ней основание и наоборот. Например, НCl – сильная кислота, значит, ион Cl– является чрезвычайно слабым основанием.
Для водных растворов численные значения констант кислотности и основности (теория Бренстеда и Лоури) совпадают со значениями констант диссоциации (ионизации) (теория Аррениуса), поэтому можно пользоваться справочной литературой, составленной на основе классической теории. Для молекулярных кислот и оснований константы Kа и Kb, а также их отрицательные логарифмы рKa и рKb приведены в таблицах, для катионных и анионных протолитов эти значения рассчитываются по формулам (3.1) или (3.2).
Равновесия в водных растворах кислот, оснований и амфолитов. Расчет рН протолитических систем
Водородный показатель рН – это отрицательный логарифм активности или концентрации ионов Н+ (ионов гидроксония Н3О+):
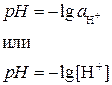
Расчет численного значения рН проводят с точностью до сотых долей единицы рН, например рН = 6,15.
Рассмотрим наиболее распространенные случаи расчета рН.






