5.3. Ќ2–ќ4-;††††††††††††† †††††††††††††††††††††††††† 5.4. Ќ3–ќ4.
6. ”кажите сопр€женное основание дл€ протолитической кислоты HSO3-:
6.1. SO32-;††††††††††††††††††††††††††††††† †††††††††† 6.2. H2O;
6.3. H2SO3;†††††††††††† †††††††††††††††††††††††††† 6.4. OH-.
7. акое уравнение следует выбрать дл€ доказательства основных свойств иона HS-?
7.1. HS- + H2O ↔ S2- + H3O+;
7.2. HS- + H2O ↔ H2S + OH-;
7.3. H2S ↔ H+ + HS-;
7.4. H2S ↔ 2H+ + S2-.
8. ѕо какой формуле можно оценить константу протолиза следующей протолитической реакции:
CN- + HCO3- ↔ HCN + CO32-
8.1.  ††††††††† †††††††††† 8.2.
††††††††† †††††††††† 8.2. 
8.3. 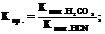 ††††††††††††††††††††††† 8.4.
††††††††††††††††††††††† 8.4. 
9. акое из указанных веществ €вл€етс€ более сильным протолитическим основанием?
9.1. NH3;††††††††††††††††††††††††††††††††† †††††††††† 9.2. (CH3)2NH;
9.3. CH3NH2;†††††††††††††††††††††††††† †††††††††† 9.4. C6H5NH2.
10. √идролиз какого иона будет протекать более полно?
10.1. Ќ—ќ3-;††††††††††††††††††††††††††† †††††††††† 10.2. S2-;
10.3. HSO3-;†††††††††††††††††††††††††††† †††††††††† 10.4. —Ќ3—ќќ-.
«адачи и упражнени€
†††††††††† 1. акие из следующих частиц могут выполнить роль протолитической кислоты: H2PO4-; NH3; H2O; HS-; H2S;  †[Zn(H2O)4]2+; (CH3)2NH?
†[Zn(H2O)4]2+; (CH3)2NH?
2. акие из приведенных частиц про€вл€ют свойства протолитического основани€: C6H5-NH2; OH-; H2O; NH4+; HSO3-; Ќ–ќ42-?
3. ”кажите, к какому типу растворителей относ€тс€: вода; спирт (R-OH); аммиак; уксусна€ кислота.
4. ”кажите сопр€женную кислоту дл€ следующих оснований: NH3; H2O; HPO42-; [Zn(OH)(H2O)3]+.
5. ”кажите сопр€женное основание дл€ следующих кислот: HNO2; H2O; H2PO4-; NH4+; NH2-CH2-COOH.
6. ƒокажите кислотно-основной характер следующих частиц: H3O+; HCO3-; OH-; ClH2C-COO-; CH3COOH; NH2-CH2-COOH. «апишите уравнени€ протолитических процессов.
7. «акончите уравнени€ следующих протолитических процессов:
HS- + H2O ↔†††††††††††††††††††††††††††††††††† HS- + OH-↔
HNO2 + H2O ↔†††††††††††††† †††††††††† NH3 + HS-↔
NH3 + H2O ↔††††††††††††††††††††††††††††††††† NH4+ + H2O ↔††††
H2O + H2O ↔††††††††††††††††††††††††††††††††† CH3COO- + NH4+ ↔
H2PO4- + H2O ↔††††††††††††† †††††††††† HPO42- + H2O ↔
”кажите сопр€женные пары кислот и оснований. ”кажите типы протолитических реакций.
8. ќцените константы протолиза дл€ следующих реакций: †††††††††† ќЌ- + Ќ2–ќ4- ↔††††††††††††† †††††††††† Ќ3ќ+ + Ќ–ќ42- ↔
—Ќ3—ќќ- + Ќ2ќ ↔††††††††††††††††††††††† ќЌ- + Ќ—ќ3- ↔
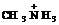 †+ ќЌ- ↔
†+ ќЌ- ↔
—делайте вывод о полноте протекани€ процесса.
9. Ќа основании расчета констант протолиза соответствующих процессов докажите, что водный раствор NaH2PO4 имеет кислую среду, а водный раствор Na2HPO4 Ц щелочную.
10. акой из перечисленных ниже протолитических процессов имеет меньшее значение константы равновеси€:
CN- + CH3COOЌ ↔†††††††††††††††††††††† CN- + HCO3- ↔
CN- + C6H5COOH ↔†††††††††††††††††††† CN- + H3BO3 ↔
CN- + HSO4- ↔
†††††††††† 11. јммиак или метиламин в большей мере будет подвергатьс€ протонированию при добавлении небольшого количества муравьиной кислоты к смеси аммиака и метиламина? «апишите уравнени€ процессов. —равните константы протолиза.
|
|
|
†††††† 12. √идролиз какого иона будет протекать более полно: S2-; HCO3-; CH3COO-. ќтвет подтвердите расчетом.
†††††††††† 13. акому протолитическому основанию соответствует более сильна€ протолитическа€ кислота: (CH3)2NH; C6H5NH2; NH3; CH3-NH2? ƒайте по€снени€.
†††††† 14. ¬ состав гемоглобиновой и оксигемоглобиновой буферных систем организма вход€т кислоты HHb и HHbO2 и их калиевые соли KHb и KHbO2. акие компоненты буфера более эффективны в процессах св€зывани€ кислых продуктов метаболизма? ќсновных продуктов? ƒайте по€снени€. «апишите уравнени€ протолитических процессов.
†††††† 15. √идролиз какого иона будет протекать более полно: [Zn(H2O)4]2+ или NH4+? ќтвет подтвердите расчетом констант протолиза. 
††† 16. †”равнени€ми соответствующих процессов докажите, что дл€ частицы HSO3- характерны свойства амфолита.
†††††† 17. акой из указанных растворителей €вл€етс€ амфипротонным: а) —Ќ3—ќќЌ; б) NH3; в) NH2-CH2COOH; г) Ќ—1? акие свойства про€вл€ет растворенное вещество в выбранном растворителе? ѕриведите примеры соответствующих протолитических процессов.
†††††† 18. ƒокажите, что фенол €вл€етс€ амфипротонным раство-рителем. ƒл€ доказательства запишите уравнени€ протолитичеких процессов и выражени€ дл€ расчета констант протолиза.
“≈ћј VIII. Ѕ”‘≈–Ќџ≈ —»—“≈ћџ
†††††††††† —войством всех живых организмов €вл€етс€ посто€нство рЌ биологических жидкостей, тканей и органов. Ёто посто€нство поддерживаетс€ их буферными системами и необходимо дл€ обеспечени€ нормальной де€тельности ферментов, регулировани€ осмотического давлени€ и других показателей.
†††††††††† «нани€ по теме ЂЅуферные системыї необходимы дл€ понимани€ механизма их действи€, количественной оценки способности буферных систем св€зывать посторонние кислоты и щелочи, понимани€ †их †взаимосв€зи †и роли †в †поддержании †кислотно-основного †гомеостаза.
†††††††††† роме того, важно уметь готовить буферные растворы дл€ последующего использовани€ их в различных медико-биологических, химических и клинических исследовани€х.
†††††††††† ѕо теме VIII студент должен знать определение пон€тий: буферный раствор, буферна€ емкость; типы буферных растворов, механизм их действи€; способы расчета рЌ буферных систем; биологические буферные системы; уметь рассчитывать рЌ буферного раствора по известному составу; оценивать вли€ние разбавлени€, добавлени€ сильных кислот и оснований на значение рЌ; владеть навыками приготовлени€ буферного раствора с заданным значением рЌ; навыками экспериментальной оценки буферной емкости приготовленного раствора.
¬опросы дл€ подготовки
1. Ѕуферные системы, их классификаци€ и механизм действи€.
2. –асчет рЌ и рќЌ. ‘акторы, вли€ющие на величину рЌ буферной системы. ¬ли€ние добавлени€ кислоты и основани€ на рЌ буферных систем различного типа.
3. Ѕуферна€ емкость как характеристика буферного действи€. ‘акторы, вли€ющие на буферную емкость растворов.
4. Ѕуферные системы в организме человека. Ѕуферное соотношение, емкость. ћеханизм буферного действи€. Ѕиологическа€ роль.
5. Ѕелковые буферные системы. ћеханизм их действи€. Ѕиологическа€ роль.
6. Ѕуферные системы крови. »х состав, буферное соотношение, емкость. ћеханизм буферного действи€. Ѕиологическа€ роль.
|
|
|
7. Ѕуферные системы, образуемые эфирами фосфорных кислот.
8. Ѕуферные системы в выделительном почечном цикле. ћеханизм их действи€. Ѕуферное соотношение и емкость.
“есты
1. Ѕуферна€ система второго типа состоит из:
1.1. слабого основани€ и соли этого основани€ и сильной кислоты;
1.2. слабой кислоты и соли этой кислоты и сильного основани€;
1.3. двух солей;
1.4. сильного основани€ и соли этого основани€ и сильной кислоты.
2. буферным системам первого типа относитс€:
2.1. пиридинова€;
2.2. ацетатна€;
2.3. аммиачна€.
3. ¬ фосфатной неорганической буферной системе роль протолитической кислоты выполн€ет:
3.1. Ќ3–ќ4; †††††††††† 3.2. Ќ–ќ42-;††††††††††††††††††††† 3.3. Ќ2–ќ4-
4. ¬одородный показатель буферного раствора первого типа рассчитываетс€ по формуле:
4.1. 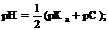
4.2. 
4.3. 
4.4. 
5. ѕри добавлении посторонней сильной кислоты к аммиачной буферной системе протекает процесс:
5.1. NH4+ + H2O ↔ NH3∙H2O + H+;
5.2. NH3∙H2O ↔ NH4+ + OH-;
5.3. H3O+ + NH3∙H2O ↔ NH4+ + 2H2O;
5.4. NH4+ + OH- ↔ NH3∙H2O
6. ≈диницей измерени€ буферной емкости €вл€етс€:
6.1. моль∙л-;†††††††††††††††††††††††††††††††††††††††††† 6.2. моль∙кг-;
6.3. ммоль∙л-;††††††††††††††††††††††††††††††††††††††† 6.4. моль экв∙л-
7. аково буферное отношение дл€ гидрокарбонатной буферной системы, если она обладает большей буферной емкостью по кислоте?
7.1.  †††††††††† 7.2.
†††††††††† 7.2.  †††††††††††††††††††† 7.3.
†††††††††††††††††††† 7.3. 
8. ƒл€ фосфатной буферной системы, состо€щей из 100 мл †††††††††0,1ћ NaH2PO4 и 100 мл 0,2ћ Na2HPO4:
8.1. ¬к > ¬о; †††††††††† 8.2. ¬к < ¬о;†††† †††††††††† 8.3. ¬к = ¬о
9. ака€ буферна€ система обладает большей емкостью по кислоте, чем по основанию?
9.1. 100 мл 0,1 ћ Ќ2—ќ3
100 мл 0,1 ћ NaHCO3;
9.2. 50 мл 1 ћ Ќ2—ќ3
100 мл 1 ћ NaHCO3;
9.3. 100 мл 1 ћ Ќ2—ќ3
50 мл 1 ћ NaHCO3;
9.4. 200 мл 0,5 ћ Ќ2—ќ3
100 мл 0,5 ћ NaHCO3
10. ѕри ацидозе в качестве экстренной меры не используют раствор:
10.1. гидрокарбоната натри€;
10.2. аскорбиновой кислоты;
10.3. лактата натри€;
10.4. трисамина H2NC(CH2OH)3.
«адачи и упражнени€
1. –ассчитайте буферную емкость аммиачной буферной системы, если при добавлении к 30 мл буфера 3 мл 0,1ћ Ќ—1 рЌ изменилс€ на 0,2, а при добавлении 3 мл 0,2ћ NaOH рЌ изменилс€ на 1. —равните ¬к и ¬о. ќтвет подтвердите уравнени€ми реакций.
2. —колько мл 0,1ћ раствора NH3∙Ќ2ќ и 0,1ћ раствора NH4Cl необходимо дл€ приготовлени€ 100 мл буферного раствора с ††††††††††рќЌ = 3,76, р в = 4,76. ака€ емкость (по кислоте или по основанию) будет больше? ќтвет подтвердите уравнени€ми реакций.
3. –ассчитайте буферную емкость гемоглобинового буфера, если при добавлении к 20 мл буферной системы 2 мл 0,1ћ Ќ—1 рЌ изменилс€ на 0,05, а при добавлении 2 мл 0,1ћ ќЌ рЌ изменилс€ на 0,5. —равните ¬к и ¬о. ќтвет подтвердите уравнени€ми реакций.
4. –ассчитайте буферную емкость фосфатного буфера по кислоте и основанию, если при добавлении к 500 мл буферной системы 10 мл 0,1ћ Ќ—1 рЌ уменьшилс€ на 0,3, а при добавлении 10 мл NaOH (0,1ћ) рЌ увеличилс€ на 0,1. ѕокажите механизм буферного действи€.
5. –ассчитайте буферную емкость гидрокарбонатного буфера по кислоте и по основанию, если при добавлении к 50 мл буферного раствора 10 мл1ћ NaOH рЌ изменилс€ на 0,2, а при добавлении 10 мл 1ћ Ќ—1 Ц на 0,1. —равните ¬к и ¬ос. акого компонента в буферной системе больше? ќтвет обоснуйте, записав уравнени€ реакций.
6. —колько мл 0,2ћ NaHCO3 и 0,1ћ Ќ2—ќ3 необходимо дл€ приготовлени€ 60 мл буферной системы с рЌ = 6,8,  †6,35. —равните ¬к и ¬о приготовленного буфера. ƒайте по€снени€, запишите уравнени€ реакций.
†6,35. —равните ¬к и ¬о приготовленного буфера. ƒайте по€снени€, запишите уравнени€ реакций.
7. –ассчитайте рЌ гидрокарбонатного буфера, состо€щего из 0,2ћ Ќ2—ќ3 50 мл и 0,1ћ NaHCO3 Ц 100 мл.  †6,35. —равните ¬к и ¬о. дайте по€снени€.
†6,35. —равните ¬к и ¬о. дайте по€снени€.
8. –ассчитайте рЌ фосфатной буферной системы, приготовленной из 100 мл 0,3ћ раствора гидрофосфата натри€ и 50 мл 0,03ћ раствора дигидрофосфата натри€. 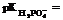 7,20. Ќапишите механизм буферного действи€. —равните ¬к и ¬о. ќтвет обоснуйте.
7,20. Ќапишите механизм буферного действи€. —равните ¬к и ¬о. ќтвет обоснуйте.
|
|
|
9. –ассчитайте рЌ аммиачной буферной системы, приготовленной из 50 мл 0,1ћ гидрата аммиака и 50 мл 0,2ћ хлорида аммони€.  4,76. —равните ¬к и ¬о. покажите механизм буферного действи€.
4,76. —равните ¬к и ¬о. покажите механизм буферного действи€.
10. –ассчитайте рЌ оксигемоглобиновой буферной системы, состо€щей из 50 мл 1ћ раствора KHbO2 и 5 мл 1ћ раствора HHbO2.  †6,95. Ќапишите механизм буферного действи€. —равните ¬к и ¬о данного буфера.
†6,95. Ќапишите механизм буферного действи€. —равните ¬к и ¬о данного буфера.
11. 200 мл 0,1ћ пропионатного буферного раствора добавили
100 мл 0,1н сол€ной кислоты. –ассчитайте рЌ и буферную емкость по кислоте. а= 1,35∙10-5.
12. –ассчитайте рЌ буферного раствора, приготовленного из равных объемов 0,2 ћ раствора гидрофосфата кали€ и 0,1ћ раствора дигидрофосфата кали€. ѕокажите механизм буферного действи€.
13. ”глекислый газ, образующийс€ в результате окислени€ веществ в ткан€х организма, переноситс€ кровью к легким. „астично он находитс€ в растворе в виде угольной кислоты, а частично в виде гидрокарбонат-иона. ≈сли рЌ крови 7,4, то кака€ дол€ угольной кислоты находитс€ в виде гидрокарбонат-иона?  †6,35. ака€ емкость больше у гидрокарбонатного буфера? ќтвет мотивируйте уравнени€ми реакций.
†6,35. ака€ емкость больше у гидрокарбонатного буфера? ќтвет мотивируйте уравнени€ми реакций.
14. ак изменитс€ рЌ при добавлении к смеси, состо€щей из 100 мл 0,1ћ раствора аминоуксусной кислоты и 300 мл 0,1ћ раствора натриевой соли этой кислоты, 20 мл 1ћ сол€ной кислоты?  †9,78. –ассчитайте буферную емкость по кислоте. ќтвет подтвердите уравнени€ми реакций.
†9,78. –ассчитайте буферную емкость по кислоте. ќтвет подтвердите уравнени€ми реакций.
15. „ему равно соотношение сероводородной кислоты и гидросульфид-иона при рЌ = 8, если  = 1,1∙10-7. ак изменитс€ рЌ при добавлении к 1 л данного раствора 0,1 мол€ гидроксида натри€? ќтвет подтвердите уравнени€ми реакций.
= 1,1∙10-7. ак изменитс€ рЌ при добавлении к 1 л данного раствора 0,1 мол€ гидроксида натри€? ќтвет подтвердите уравнени€ми реакций.
16. акой концентрации нужно вз€ть раствор ацетата натри€ дл€ приготовлени€ 1 л буферного раствора с рЌ = 5,48, если имеетс€ †††††500 мл 0,1ћ раствора уксусной кислоты? р = 4,78. ќцените буферную емкость. ќтвет подтвердите уравнени€ми реакций.
17. ќпределите рЌ буферного раствора, содержащего в 1 л 0,4 моль муравьиной кислоты и 1,0 моль формиата натри€ до разбавлени€ и после разбавлени€ в 50 раз.
†††††††††† 18. рЌ мочи в норме 4,7-6,5, а при нарушени€х кислотно-щелочного равновеси€ может измен€тьс€ в пределах 4,5-8,5. ѕри каких соотношени€х NaH2PO4 и Na2HPO4 рЌ мочи становитс€ равным: а) 4,5; б) 8,5?
19. ѕри сахарном диабете в организме происходит интенсивное образование кислых продуктов метаболизма, что вызывает сдвиг рЌ крови в кислую сторону (ацидеми€). ѕри снижении на длительное врем€ рЌ крови до 7,0 может наступить угрожающее дл€ жизни состо€ние. –ассчитайте, при каких соотношени€х компонентов буферных систем Ќ—ќ3-/Ќ2—ќ3 и Ќ–ќ42-/Ќ2–ќ4- рЌ крови становитс€ равным 7.
20. ѕри определении альбумина по реакции с бромкрезоловым зеленым примен€ют ацетатный буфер. ”ксусную кислоту объемом 50 мл смешивают с 13,2 мл раствора NaOH (концентрации растворов равны 1 моль/л) и объем довод€т дистиллированной водой до 1 л. ¬ычислите рЌ используемого буферного раствора.
21. акие из перечисленных веществ и в каких сочетани€х можно вз€ть дл€ приготовлени€ буферных растворов: аммиак, уксусна€ кислота, сол€на€ кислота, кали€ гидроксид, натри€ дигидрофосфат, натри€ хлорид, кали€ сульфат, кали€ гидрофосфат?
22. –асположите приведенные ниже буферные системы с эквимол€рным соотношением компонентов в пор€дке увеличени€ в них концентрации гидроксид-ионов: а) гидрокарбонатна€; б) ацетатна€; в) аммиачна€; г) фосфатна€.
23. ”кажите диапазон значений рЌ, который способны поддерживать следующие буферные системы: а) ацетатна€; б) аммиачна€; в) гидрокарбонатна€; †г) фосфатна€. ƒайте по€снени€.
“≈ћј IX. ќ »—Ћ»“≈Ћ№Ќќ-¬ќ——“јЌќ¬»“≈Ћ№Ќџ≈
–ј¬Ќќ¬≈—»я » ѕ–ќ÷≈——џ
†††††††††† “еори€ окислительно-восстановительных равновесий позвол€ет пон€ть сущность протекающих в организме редокс-процессов, на которых основано превращение химической формы движени€ материи в биологическую; механизм действи€ редокс-буферных систем, а также причины возникновени€ некоторых патологических состо€ний. «нани€ по указанной теме позвол€ют обосновать применение в фармакотерапии окислителей, восстановителей и антиоксидантов; пон€ть сущность методов оксидиметрии, используемых в клинической биохимии дл€ диагностики заболеваний, а также в санитарии и гигиене дл€ анализа продуктов питани€, питьевой воды и объектов окружающей среды.
|
|
|
†††††††††† ѕо теме IX студент должен знать пон€ти€: степень окислени€, окислитель, восстановитель, редокс-сопр€женна€ система, редокс-потенциал; термодинамические услови€ протекани€ окислительно-восстанови-тельной реакции; уметь прогнозировать образование продуктов окислительно-восстанови-тельного процесса в зависимости от характера среды; рассчитывать мол€рные массы эквивалентов окислител€ и восстановител€; владеть методами электронного и ионно-электронного балансов; навыками прогнозировани€ веро€тности и направлени€ окислительно-восстановительного процесса.
¬опросы дл€ подготовки
1. ѕон€ти€ электроотрицательности и степени окислени€.
2. ќсновные положени€ окислительно-восстановительных реакций:
2.1. процессы окислени€ и восстановлени€;
2.2. изменение восстановительных и окислительных свойств элементов в зависимости от положени€ в периодической системе.
3. лассификаци€ окислительно-восстановительных реакций.
4. ћетоды составлени€ уравнений реакций:
метод электронного баланса; метод ионно-электронного баланса.
5. ¬ли€ние среды на протекание реакций окислени€-восстановлени€.
6. ќкислительно-восстановительный потенциал как мера окислительной и восстановительной способности систем:
6.1. стандартные окислительно-восстановительные потенциалы;
6.2. формальные (мидпойнт) потенциалы.
7. ќпределение направлени€ окислительно-восстановительных реакций по величинам окислительно-восстановительных потенциалов.
8. –асчет мол€рной массы эквивалента окислител€ и восстановител€.
9. ќксидимери€, йодометри€ и перманганатометри€. ѕрименение оксидиметрии в санитарно-гигиенических и клинических исследовани€х.
10. –едокс-буферные системы организма.
“есты
1. акое из веществ может быть только окислителем?
1.1. K2SO3;†††††††††††††††††††††††††††††† †††††††††† 1.2. Al;
1.3. KMnO4;††††††††††††††††††††††††††† †††††††††† 1.4. FeSO4.
2. акое из веществ может быть только восстановителем?
2.1. K2Cr2O7;††††††††††††††††††††††††††† 2.2. FeSO4;
2.3. Fe2(SO4)3;††††††††††††††††††††††††††††††††††††††††† 2.4. PbO2.
3. –ассчитайте мол€рную массу эквивалента окислител€ в реакции:
KMnO4 + FeSO4 + H2SO4 → MnSO4 + Fe2(SO4)3 + K2SO4 + H2O
3.1. 32;†††† 3.2. 44; †††††††††† 3.3. 56; †††††††††† 3.4. 28
4. ”кажите тип реакции: —1ќ3 → —1ќ4 + —1
4.1. межмолекул€рна€;
4.2. внутримолекул€рна€;
4.3. диспропорционировани€.
5. акое соединение может про€вл€ть как окислительные, так и восстановительные свойства?
5.1. KMnO4;†††††††††††††††††††††††††††††††††††††††††† 5.2. FeSO4;
5.3. KI;††††††††††††††††††††††††††††††††††††††††††††††††††† 5.4. Na2SO3
6. –ассчитайте мол€рную массу эквивалента восстановител€ в реакции
FeCl3 + KI → FeCl2 + I2 + KCl:
6.1. 166;† †††††††††† 6.2. 83; †††††††††† 6.3. 55; †††††††††† 6.4. 42
7. ака€ из систем про€вл€ет самые сильные окислительные свойства?
7.1. MnO4- + 5e + 8H+ ↔ Mn2+ + 4H2O;
7.2. Cо3+ + e ↔ Cо2+;
7.3. Cr2O72- + 14H+ + 6e ↔ 2Cr3+ + 7H2O;
7.4. BrO3- + 3H2O + 6e ↔ Br- + 6OH-
8. ака€ из систем обладает самым сильным восстановительным свойством?
8.1. Al3+ + 3e ↔ Alo;
8.2. Fe3+ + e ↔ Fe2+;
8.3. SO42- + H2O + 2e ↔ SO32- + 2OH-;
8.4. NO3- + 2H+ + 2e ↔ NO2- + H2O
9. акое вещество не может окислить Fe2+ до Fe3+:
9.1. KMnO4;†††††††††††††††††††††††††† †††††††††† 9.2. K2Cr2O7;
9.3. I2;††††††††††††††††††††††††††††††††††††† †††††††††† 9.4. NaBiO3
10. акое вещество не может восстановить Cr2O72- до Cr3+:
10.1. KI;††††††††††††††††††††††††††††††††† †††††††††† 10.2. Ќ2—2ќ4;
10.3. MnSO4;†††††††††††††††††††††††† †††††††††† 10.4. H2O2
«адачи и упражнени€
†††††††††† 1. «акончите уравнени€ методом ионно-электронного баланса. ”кажите окислитель, восстановитель, тип реакции. –ассчитайте мол€рную массу эквивалента окислител€ и восстановител€.
1.1. CuS + HNO3 → Cu(NO3)2 + H2SO4 + NO2 + Е
1.2. FeCl2 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + Е
1.3. AsH3 + AuCl3 + NaOH → Na3AsO4 + Au + Е
1.4. Cr2(SO4)3+NaBiO3+NaOH → Na2CrO4 + Bi(OH)3 + Е
|
|
|
1.5. HCN + O2 → CO2 + N2 + Е
1.6. KNO2 + KMnO4 + H2SO4 → KNO3 + MnSO4 + Е
1.7. Al + NaNO3 + NaOH → NaAlO2 + NH3
1.8. MnO2 + H2O2 + H2SO4 → MnSO4 + O2 + Е
1.9. KMnO4 + C6H12O6 + H2SO4 → CO2 + MnSO4 + Е
1.10. MnSO4 + H2O2 + KOH → MnO2 + K2SO4 + Е
1.11. K2Cr2O7 + KI + H2SO4 → I2 + Cr2(SO4)3 + Е
1.12. KIO3 + KI + H2SO4 → I2 + K2SO4 + Е
1.13. NH4Cl + NaNO3 → N2 + NaCl + HCl + Е
1.14. H3PO3 + KMnO4 + H2SO4 → H3PO4 + MnSO4 + Е
1.15. HNO3 + P → H3PO4 + NO + Е
1.16. Na2SO3 + PH3 → S + P + Е
1.17. NaAsO2+I2+Na2CO3+H2O→NaH2AsO4+NaI+CO2 + Е
1.18. K3FeO3 + K—lO4 + H2SO4 → K2FeO4 + Cl2 + Е
1.19. PH3 + KMnO4 + H2SO4 → H3PO4 + MnSO4 + Е
1.20. Al + KNO2 + KOH → K[Al(OH)4] + NH3
1.21. As2O3 + HNO3 + H2O → H3AsO4 + NO
1.22. K2CrO4 + NaNO2 + H2SO4 → Cr2(SO4)3 + NaNO3 + Е
1.23. KCrO2 + NaClO + KOH → K2CrO4 + NaCl + Е
1.24. H—lO3 + H2S → HCl + S
1.25. SO2 + H2S → S + H2O
2. ака€ реакци€ произойдет, если привести в контакт следующие две равновесные окислительно-восстановительные системы. Ќапишите уравнени€ реакций. ”кажите окислитель и восстановитель.
2.1. †††††Cr2O72- + 14H+ + 6e ↔ 2Cr3+ + 7H2O ≈о = 1,33 ¬
2—O2 + 2H+ + 2e ↔ H2C2O4†††††††††††††††††††††††† ≈о =-0,49 ¬
2.2. †††††MnO4- + 4H+ + 3e ↔ MnO2 + 2H2O †††††††††† ≈о = 1,69 ¬
HNO2 + H+ + e ↔ NO + H2O††††††††††††††††††††††† ≈о = 0,99 ¬






