077-140
ћ≈“ќƒ»„Ќ≤ ¬ ј«≤¬ »
до виконанн€ контрольноњ роботи з навчальноњ
дисципл≥ни Д’≥м≥€Ф дл€ студент≥в заочноњ форми навчанн€
за напр€мом п≥дготовки 6.060101 ДЅуд≥вництвоФ
«атверджено на зас≥данн≥
методичноњ ком≥с≥њ
напр€му п≥дготовки
6.060101 ДЅуд≥вництвоФ
ѕротокол є3 в≥д 24.11.2010 р.
–≥вне Ц 2010
ћетодичн≥ вказ≥вки до виконанн€ контрольноњ роботи з навчальноњ
дисципл≥ни Д’≥м≥€Ф дл€ студент≥в заочноњ форми навчанн€ за напр€мом п≥дготовки 6.060101 ДЅуд≥вництвоФ/ ≤.™.ћанековська - –≥вне: Ќ”¬√ѕ, 2010. Ц 28 с.
”пор€дник: ≤.™.ћанековська, доцент кафедри х≥м≥њ.
¬≥дпов≥дальний за випуск: ћ.¬.яцков, канд.техн.наук,
зав≥дувач кафедри х≥м≥њ
© ≤.™.ћанековська ≤.™., 2011
© Ќ”¬√ѕ, 2011
« ћ ≤ — “
—тор.
ѕ≈–≈ƒћќ¬ј................................................................................4
“≈ћј 1. ќ—Ќќ¬Ќ≤ ѕќЌя““я “ј «ј ќЌ» ’≤ћ≤ѓ............5
1.1. ¬изначенн€ в≥дносних молекул€рних та мол€рних
мас газопод≥бних речовин..................................................................5
1.2. ’≥м≥чний екв≥валент. «акон екв≥валент≥в..............................5
“≈ћј 2. Ѕ”ƒќ¬ј ј“ќћј. ѕ≈–≤ќƒ»„Ќ»… «ј ќЌ
≤ ѕ≈–≤ќƒ»„Ќј —»—“≈ћј ≈Ћ≈ћ≈Ќ“≤¬ « ѕќ√Ћяƒ”
Ѕ”ƒќ¬» ј“ќћј..............................................................................6
“≈ћј 3. ’≤ћ≤„Ќј ≤Ќ≈“» ј ≤ –≤¬Ќќ¬ј√ј.....................7
3.1. Ўвидк≥сть х≥м≥чних реакц≥й....................................................7
3.2. ’≥м≥чна р≥вновага. «м≥щенн€ р≥вноваги. ѕринцип
Ће ЎательЇ..........................................................................................8
“≈ћј 4. –ќ«„»Ќ». —ѕќ—ќЅ» ¬»–ј∆≈ЌЌя
— Ћјƒ” –ќ«„»Ќ≤¬.......................................................................9
“≈ћј 5. –≈ј ÷≤ѓ ќЅћ≤Ќ” ¬ –ќ«„»Ќј’ ≈Ћ≈ “–ќ-
Ћ≤“≤¬...................................................................................................10
“≈ћј 6. ƒ»—ќ÷≤ј÷≤я ¬ќƒ». ¬ќƒЌ≈¬»… ѕќ ј«Ќ» 11
“≈ћј 7. √≤ƒ–ќЋ≤« —ќЋ≈…......................................................12
“≈ћј 8. ќ »—Ќќ-¬≤ƒЌќ¬Ќ≤ –≈ј ÷≤ѓ...............................12
“≈ћј 9. –яƒ —“јЌƒј–“Ќ»’ ≈Ћ≈ “–ќƒЌ»’
ѕќ“≈Ќ÷јЋ≤¬ ћ≈“јЋ≤¬...............................................................13
“≈ћј 10. √јЋ№¬јЌ≤„Ќ≤ ≈Ћ≈ћ≈Ќ“»..................................13
“≈ћј 11. ќ–ќ«≤я ћ≈“јЋ≤¬ ≤ «ј’»—“ ¬≤ƒ ќ–ќ«≤ѓ....14
“≈ћј 12. “¬≈–ƒ≤—“№ ¬ќƒ»....................................................15
ѕ–» Ћјƒ» –ќ«¬Тя«”¬јЌЌя «ј¬ƒјЌ№............................16
Ћ≤“≈“ј“”–ј................................................................................28
ѕ≈–≈ƒћќ¬ј
«а навчальним планом студенти заочноњ форми навчанн€ за напр€мом ДЅуд≥вництвоФ при вивченн≥ дисципл≥ни Д’≥м≥€Ф виконують одну контрольну роботу. онтрольна робота виконуЇтьс€ в зошит≥ з пол€ми. ќбовТ€зково треба писати умови завдань. ¬≥дпов≥д≥ мають бути ч≥тк≥, лакон≥чн≥, аргументован≥, а розвТ€зки задач повинн≥ супроводжуватись в≥дпов≥дними по€сненн€ми. ¬ар≥ант контрольноњ роботи визначаЇтьс€ за останньою цифрою зал≥ковоњ книжки. Ќалежним чином оформлена робота надсилаЇтьс€ на кафедру х≥м≥њ на реценз≥ю не п≥зн≥ше н≥ж за два тижн≥ до екзаменац≥йноњ сес≥њ. «а умови недотриманн€ ус≥х вимог щодо виконанн€ контрольноњ роботи, робота повертаЇтьс€ студенту дл€ доопрацюванн€. ¬иправленн€ помилок з врахуванн€м зауважень викладача маЇ бути виконане в тому самому зошит≥. ѕ≥сл€ доопрацюванн€ робота надсилаЇтьс€ дл€ повторного рецензуванн€. «а в≥рно виконану ≥ захищену контрольну роботу нараховуЇтьс€ до 30 б≥л≥в.
|
|
|
“≈ћј 1. ќ—Ќќ¬Ќ≤ ѕќЌя““я “ј «ј ќЌ» ’≤ћ≤ѓ
1.1.¬изначенн€ в≥дносних молекул€рних та мол€рних
мас газопод≥бних речовин
¬ар≥анти завдань
1. ћаса 344 мл газу при температур≥ 420— ≥ тиску 772 мм рт.ст. дор≥внюЇ 0,865 г. ќбчислити в≥дносну молекул€рну масу газу.
2. ћаса 85,5 мл пари метанолу при температур≥ 910— ≥ тиску 768 мм рт.ст. дор≥внюЇ 0,0925 г. ќбчислити мол€рну масу спирту.
3. ћаса 87 мл пари при температур≥ 620— ≥ тиску 758 мм рт.ст. дор≥внюЇ 0,24 г. ќбчислити в≥дносну молекул€рну масу речовини.
4. ѕара с≥рки при температур≥ вище 3000— маЇ густину в≥дносно водню 32. ќбчислити молекул€рну масу с≥рки при ц≥й температур≥ ≥ встановити, ск≥льки атом≥в —ульфуру входить до складу його молекули.
5. ќбчислити мол€рну масу газу, €кщо маса газу дор≥внюЇ 1,714 г ≥ займаЇ обТЇм 600 мл за нормальних умов.
6. ћаса 0,001 м3 газу за нормальних умов дор≥внюЇ 0,0021 кг. ¬изначити мол€рну масу газу та його густину в≥дносно пов≥тр€.
7. ќбчислити мол€рну масу ацетону, €кщо маса 500 мл його пари при температур≥ 870— ≥ тиску 96 кѕа дор≥внюЇ 0,93 г.
8. ћаса 624 мл газу при температур≥ 170— ≥ тиску 104 кѕа дор≥внюЇ 1,56 г. ќбчислити в≥дносну мол€рну масу газу.
9. ћаса 1 л газу за нормальних умов дор≥внюЇ 1,25 г. ќбчислити: а) в≥дносну молекул€рну масу; б) масу молекули газу.
10. ћаса 1 л де€кого газу за нормальних умов дор≥внюЇ 1,52 г, а маса 1 л азоту дор≥внюЇ 1,25 г. ќбчислити мол€рну масу газу.
1.2.’≥м≥чний екв≥валент. «акон екв≥валент≥в
¬ар≥анти завдань
1. ƒл€ повного в≥дновленн€ 1,59 г оксиду металу до металу використано 478 мл водню при температур≥ 70— ≥ тиску 730 мм рт.ст. ¬изначити мол€рну масу екв≥валента металу.
2. 0,934 г металу вит≥снили з хлоридноњ кислоти 348 мл водню при температур≥ 200— ≥ тиску 750 мм рт.ст. ќбчислити мол€рну масу екв≥валента металу.
3. ћол€рна маса екв≥валента металу дор≥внюЇ 8,99 г/моль. який обТЇм водню при температур≥ -30— ≥ тиску 800 мм рт.ст. можна одержати при взаЇмод≥њ 0,4495 г металу з хлоридною кислотою?
4. 1 г металу сполучаЇтьс€ з такою ж самою масою хлору, €кий займаЇ обТЇм 336 мл при температур≥ 370— ≥ тиску 735 мм рт.ст. ¬изначити мол€рну масу екв≥валента металу.
5. ќбчислити мол€рну масу екв≥валента цинку, €кщо 0,584 г його вит≥снили з кислоти 219 мл водню, вим≥р€ного при температур≥ 170— ≥ тиску 740 мм рт.ст.
6. ќбчислити мол€рну масу екв≥валента —ульфуру в сполуц≥ його з ‘ерумом, €кщо на 0,165 г —ульфуру припадаЇ 0,279 г ‘еруму ≥ €кщо валентн≥сть ‘еруму дор≥внюЇ 2.
7. ќбчислити мол€рну масу екв≥валента хлору, €кщо 0,824 г м≥д≥ зТЇднуЇтьс€ з 291 мл хлору, вим≥р€ного за н.у., а валентн≥сть м≥д≥ дор≥внюЇ 2.
8. 0,2046 алюм≥н≥ю розчинили в хлорид н≥й кислот≥. ¬одень, що вид≥ливс€, зайн€в обТЇм 274 мл при температур≥ 190— ≥ тиску 755 мм рт.ст. ќбчислити мол€рну масу екв≥валента алюм≥н≥ю.
|
|
|
9. ќбчислити мол€рну масу екв≥валента ’рому в оксид≥, в €кому м≥ститьс€ 5Ф% ’рому ≥ 48% ќксигену.
10. Ќа нейтрал≥зац≥ю 0,728 г лугу витратили 0,535 г н≥тратноњ кислоти. ќбчислити мол€рну масу екв≥валента лугу.
“≈ћј 2. Ѕ”ƒќ¬ј ј“ќћј. ѕ≈–≤ќƒ»„Ќ»… «ј ќЌ
≤ ѕ≈–≤ќƒ»„Ќј —»—“≈ћј ≈Ћ≈ћ≈Ќ“≤¬ « ѕќ√Ћяƒ”
Ѕ”ƒќ¬» ј“ќћј
Ќаписати електронн≥ формули запропонованих елемент≥в. ¬казати пер≥од, групу та електронну родину, до €коњ належить елемент. —класти енергетичн≥ схеми розпод≥лу електрон≥в по атомних електронних орб≥та л€х та визначити можливу валентн≥сть в нормальному ≥ в збудженому станах. —класти формули можливих оксид≥в ≥ можливих сполук з √≥дрогеном. «робити висновок про х≥м≥чн≥ властивост≥ елемент≥в та њхн≥х сполук на основ≥ розм≥щенн€ њх в пер≥одичн≥й систем≥.
¬ар≥анти завдань
1. ≈лемент є13 ≥ є21.
2. ≈лемент є15 ≥ є23.
3. ≈лемент є17 ≥ є25.
4. ≈лемент є20 ≥ є30.
5. ≈лемент є23 ≥ є33.
6. ≈лемент є14 ≥ є22.
7. ≈лемент є19 ≥ є29.
8. ≈лемент є16 ≥ є24.
9. ≈лемент є9 ≥ є17.
10. ≈лемент є7 ≥ є15.
“≈ћј 3. ’≤ћ≤„Ќј ≤Ќ≈“» ј ≤ –≤¬Ќќ¬ј√ј
3.1. Ўвидк≥сть х≥м≥чних реакц≥й
¬ар≥анти завдань
1. ” ск≥льки раз≥в необх≥дно зб≥льшити концентрац≥ю карбон(≤≤) оксиду в систем≥ 2—ќ(г) = —ќ2(г) + —(г), щоб швидк≥сть реакц≥њ зб≥льшилась в 4 рази?
2. Ќаписати р≥вн€нн€ швидкост≥ реакц≥њ —(гр.) + ќ2(г) = —ќ2(г) та визначити, в ск≥льки раз≥в зб≥льшитьс€ швидк≥сть реакц≥њ при зб≥льшенн≥: а) концентрац≥њ кисню в 3 рази; б) тиску в систем≥ в 4 рази.
3. –еакц≥€ м≥ж н≥троген(≤≤) оксидом та хлором в≥дбуваЇтьс€ за р≥вн€нн€м: 2NO(г) + Cl2(г) L 2NOCl(г). як зм≥нитьс€ швидк≥сть реакц≥њ при зб≥льшенн≥: а) концентрац≥њ н≥троген(≤≤) оксиду в 2 рази; б) концентрац≥њ хлору в 2 рази; 3) концентрац≥њ обох речовин в 2 рази?
4. ¬ ск≥льки раз≥в необх≥дно зб≥льшити тиск, щоб швидк≥сть утворенн€ н≥троген(IV) оксиду по реакц≥њ 2NO(г) + ќ2(г) L 2NO2(г) зб≥льшилась в 1000 раз≥в?
5. ¬ ск≥льки раз≥в необх≥дно зб≥льшити концентрац≥ю водню в систем≥ N2(г) + 3Ќ2(г) L 2NЌ3(г), щоб швидк≥сть реакц≥њ зб≥льшилась в 100 раз≥в?
6. ¬ ск≥льки раз≥в зб≥льшитьс€ швидк≥сть х≥м≥чноњ реакц≥њ при п≥двищенн≥ температури на 400, €кщо γ=3,2?
7. Ќа ск≥льки градус≥в необх≥дно п≥двищити температуру системи, щоб швидк≥сть реакц≥њ зросла в 30 раз≥в (γ=2,5)?
8. ѕри зб≥льшенн≥ температури на 500— швидк≥сть реакц≥њ зросла в 1200 раз≥в. ќбчислити γ.
9. ¬ ск≥льки раз≥в необх≥дно зб≥льшити концентрац≥ю речовини ¬2 в систем≥ 2ј2(г) + ¬2(г) = 2ј2¬(г), щоб при зменшенн≥ концентрац≥њ речовини ј в 4 рази швидк≥сть пр€моњ реакц≥њ не зм≥нилась?
10. “емпературний коеф≥ц≥Їнт швидкост≥ реакц≥њ дор≥внюЇ 2,3. ¬ ск≥льки раз≥в зб≥льшитьс€ швидк≥сть ц≥Їњ реакц≥њ., €кщо п≥двищити температуру на 25 градус≥в?
3.2. ’≥м≥чна р≥вновага. «м≥щенн€ р≥вноваги.
ѕринцип Ће ЎательЇ
¬ар≥анти завдань
1. ѕри де€к≥й температур≥ р≥вноважн≥ концентрац≥њ в систем≥ 2SO2(г) + ќ2(г) L 2SO3(г) дор≥внюють в≥дпов≥дно: [SO2] = 0,04 моль/л, [O2] = 0,06 моль/л, [SO3] = 0,02 моль/л. ќбчислити константу р≥вноваги ≥ початков≥ концентрац≥њ сульфур(IV) оксиду ≥ кисню. як треба зм≥нити концентрац≥њ реагуючих речовин, щоб р≥вновага зм≥стилась в напр€мку пр€моњ реакц≥њ?
2. ¬ стан≥ р≥вноваги в систем≥ N2(г) + 3H2(г) L 2NH3(г); ΔЌ = -92,4 кƒж концентрац≥њ реагуючих речовин дор≥внюють: [N2] = 3 моль/л, [H2] = 9 моль/л, [NH3] = 4 моль/л. ¬изначити: а) початков≥ концентрац≥њ Ќ2 та N2; б) в €кому напр€мку зм≥ститьс€ р≥вновага з ростом температури?
3. ѕри де€к≥й температур≥ р≥вновага в систем≥ 2NO2(г) L 2NO(г) + ќ2(г) встановилось при таких концентрац≥€х: [Nќ2] = 0,006 моль/л, [NO] = 0,024 моль/л. ќбчислити константу р≥вноваги ≥ початкову концентрац≥ю NO2.
4. —истема —(√–ј‘≤“) + —ќ2(г) L 2—ќ(г); ΔЌ0 = 172,5 кƒж знаходитьс€ в стан≥ р≥вноваги. ¬казати: а) €к зм≥нитьс€ вм≥ст —ќ в р≥вноважн≥й сум≥ш≥ з п≥двищенн€м температури при незм≥нному тиску; б) з ростом загального тиску при незм≥нн≥й температур≥?
|
|
|
5. ¬ €кому напр€мку зм≥ститьс€ р≥вновага:
2—ќ(г) + ќ2(г) L 2—ќ(г); ΔЌ0 = -566 кƒж;
N2(г) + ќ2(г) L 2Nќ(г); ΔЌ0 = 180 кƒж.
а) при пониженн≥ температури;
б) при п≥двищенн≥ тиску?
Ќаписати вирази констант р≥вноваги.
6. як вплине на р≥вновагу реакц≥й:
2Ќ2(г) + ќ2(г) L 2Ќ2ќ(г); ΔЌ0 = -483,6 кƒж;
—а—ќ3(к) L —аќ(к) + —ќ2(г); ΔЌ0 = 179 кƒж.
а) п≥двищенн€ тиску;
б) п≥двищенн€ температури.
Ќаписати вирази констант р≥вноваги.
7. ¬ €кому напр€мку зм≥ститьс€ р≥вновага в системах:
2ЌBr(г) L H2(г) + Br2(г); ΔЌ0 = -70,18 кƒж;
2NO(г) + ќ2(г) L 2Nќ2(г); ΔЌ0 = 117,2 кƒж.
а) при п≥двищенн≥ тиску;
б) при п≥двищенн≥ температури.
Ќаписати вирази констант р≥вноваги.
8. ¬ систем≥ —ќ(г) + —12(г) L —ќ—l2(г) –≥вноважн≥ концентрац≥њ речовин [—12] = 0,3 моль/л, [—O] = 0,2 моль/л та [—ќ—12] = 1,2 моль/л. ќбчислити константу р≥вноваги системи ≥ початков≥ концентрац≥њ хлору та карбон(≤≤) оксиду. якими зм≥нами концентрац≥й можна зм≥стити р≥вновагу вправо?
9. Ќаписати вирази констант р≥вноваги систем:
2Nќ(г) + ќ2(г) L 2Nќ2(г); ΔЌ0 = 117,2 кƒж;
4Ќ—1(г) + ќ2(г) L 2Ќ2ќ(г) + 2—12(г);
Ќ2(г) + S(к) L Ќ2S(г).
¬ €кому напр€мку зм≥ститьс€ р≥вновага в системах при п≥двищенн≥ тиску?
10. який вплив на систему 4Ќ—1(г) + ќ2(г) L 2—12(г) + 2 Ќ2ќ(г); призведе до зм≥щенн€ р≥вноваги вл≥во? Ќаписати вираз константи р≥вноваги.
“≈ћј 4. –ќ«„»Ќ». —ѕќ—ќЅ» ¬»–ј∆≈ЌЌя
— Ћјƒ” –ќ«„»Ќ≤¬
¬ар≥анти завдань
1. —к≥льки грам≥в FeCl3 м≥ститьс€ в 20 мл 40%-ного розчину, густина €кого 1,133 г/мл?
2. —к≥льки грам≥в ¬а—12 м≥ститьс€ в 25 мл: а) 0,5ћ розчину; б) 0,5 н розчину?
3. —к≥льки грам≥в кухонноњ сол≥ NaCl необх≥дно розчинити в 10 л води, щоб одержати розчин з масовою часткою 2%?
4. 2 г глюкози —6Ќ12ќ6 розчинили в 60 г води. ќбчислити мол€льну концентрац≥ю розчину ≥ масову частку глюкози в цьому розчин≥.
5. ќбчислити мол€рну та мол€рну концентрац≥ю екв≥валента розчину K2SO4, в 20 мл €кого м≥ститьс€ 1,74 г розчиненоњ речовини.
6. ¬ €к≥й к≥лькост≥ води необх≥дно розчинити 2 кг цукру, щоб одержати розчин з масовою часткою 10%?
7. —к≥льки грам≥в натр≥й фосфату необх≥дно вз€ти, щоб приготувати 2 л розчину, мол€рна концентрац≥€ екв≥валента €кого 0,5 моль-екв/л? яка мол€рна концентрац≥€ цього розчину?
8. —к≥льки грам≥в купрум(≤≤) сульфату м≥ститьс€ в 10 мл розчину, мол€рна концентрац≥€ €кого 0,2 моль/л? яка мол€рна концентрац≥€ екв≥валента цього розчину?
9. —к≥льки кг води необх≥дно додати до 1 кг розчину з масовою часткою 50%, щоб одержати розчин з масовою часткою 10%?
10. ќбчислити мол€рну концентрац≥ю розчину н≥тратноњ кислоти, масова частка €кого 10%, а густина дор≥внюЇ 1,056 г/мл.
“≈ћј 5. –≈ј ÷≤ѓ ќЅћ≤Ќ” ¬ –ќ«„»Ќј’
≈Ћ≈ “–ќЋ≤“≤¬
а) Ќаписати молекул€рн≥, йонно-молекул€рн≥ та скорочен≥ йонно-молекул€рн≥ р≥вн€нн€ реакц≥й. «робити висновок щодо необоротност≥ або оборотност≥ переб≥гу реакц≥й;
б) —класти молекул€рн≥ р≥вн€нн€ реакц≥й, що виражаютьс€ запропонованими йонно-молекул€рними р≥вн€нн€ми.
¬ар≥анти завдань
1. а) NiCl2 + H2S;
б) NO2- + H+ = HNO2.
2. а) CuSO4 + NaOH;
б) Pb2+ + 2I- = PbI2↓.
3. а) Na2SO3 + H2SO4;
б) Fe3+ + 3OH- = Fe(OH)3↓.
4. а) K2CO3 + HCl;
б) 2H+ + S2- = H2S↑.
5. а) FeS + HCl;
б)Cu2+ + 2OH- = Cu(OH)2↓.
6. а) Fe(OH)3 + HNO3;
б) HCO3- + H+ = H2CO3.
7. а) AlBr3 + AgNO3;
б) Ca2+ + CO32- = CaCO3↓.
8. а) HCl + Ba(OH)2;
б) Cu2+ + S2- = CuS↓.
9. а) H2S + NH4OH;
б) CH3COO- + H+ = CH3COOH.
10. а) Na2S + H2SO4;
б) NH4+ + OH- = NH4OH.
“≈ћј 6. ƒ»—ќ÷≤ј÷≤я ¬ќƒ». ¬ќƒЌ≈¬»… ѕќ ј«Ќ»
|
|
|
¬ар≥анти завдань
1. ¬изначити рЌ, мол€рну концентрац≥ю йон≥в ќЌ- у водних розчинах, в €ких концентрац≥€ йон≥в √≥дрогену (в моль/л) дор≥внюЇ: а) 10-3; б) 6,5 . 10-8; в) 1,4 . 10-2.
2. ¬изначити рЌ ≥ молр€ну концентрац≥ю йон≥в ќЌ- у водних розчинах, в €ких концентрац≥€ йон≥в Ќ+ (в моль/л) дор≥внюЇ: а) 2 . 10-7; б) 8,1 . 10-3; в) 2,7 . 10-10.
3. ¬изначити рЌ розчину, в 1 л €кого м≥ститьс€ 0,1 г NaOH. ƒисоц≥ац≥ю лугу вважати повною.
4. —к≥льки йон≥в Ќ+ м≥стить 1 мл розчину, рЌ €кого дор≥внюЇ 13?
5. ќбчислити рЌ розчин≥в таких сильних ≥ слабких електрол≥т≥в: 0,02ћ NH4OH; 0,01M HNќ3; 0,01M HCN; 0,001M NaOH ( = 1,8 . 10-5;
= 1,8 . 10-5; 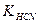 = 7,2 . 10-10).
= 7,2 . 10-10).
6. як зм≥нитьс€ рЌ розчину, €кщо в два рази розбавити водою: а) 0,2ћ розчин Ќ—1; б) 0,2ћ розчин —Ќ3—ќќЌ ( = 1,8 . 10-5)?
= 1,8 . 10-5)?
7. ¬изначити рЌ розчину, в 1 л €кого м≥ститьс€ 7,3 г Ќ—1. ƒисоц≥ац≥ю кислоти вважати повною.
8. ¬изначити рЌ та концентрац≥ю йон≥в Ќ+ в розчинах, в €ких концентрац≥€ йон≥в ќЌ- (в моль/л) дор≥внюЇ: а) 6,5 . 10-6; б) 9 . 10-9; в) 8,7 . 10-8.
9. ¬изначити мол€рн≥ концентрац≥њ сильних кислот, що мають так≥ значенн€ рЌ: а) 1,6; б) 3; в) 3,7.
10. ¬изначити мол€рн≥ концентрац≥њ сильних основ, що мають так≥ значенн€ рЌ: а) 11; б) 10,3; в) 12,7.
“≈ћј 7. √≤ƒ–ќЋ≤« —ќЋ≈…
¬казати, €к≥ з наведених солей п≥дл€гають г≥дрол≥зу. як≥ сол≥ г≥дрол≥зують ступ≥нчасто? ƒл€ €ких солей можливий сп≥льний г≥дрол≥з? Ќаписати йонно-молекул€рн≥ р≥вн€нн€ г≥дрол≥зу солей ≥ вказати рЌ њхн≥х водних розчин≥в.
¬ар≥анти завдань
1. KCl, NaNO2, FeCl3.
2. Na2SO4, Na2SO3, AlCl3.
3. Ca(NO3)2, Na2SiO3, Fe(NO3)3.
4. CuSO4, NaNO3, Na2S.
5. K2CO3, Cr(NO3)3, NaCl.
6. ZnCl2, KCN, CaCl2.
7. NH4Cl, FeCl3, K2SO4.
8. ZnBr2, K2S, Na2SO4.
9. MgSO4, K2SO3, KNO3.
10. Al2(SO4)3, Na2CO3, KBr.
“≈ћј 8. ќ »—Ќќ-¬≤ƒЌќ¬Ќ≤ –≈ј ÷≤ѓ
¬изначити ступен≥ окисненн€ елемент≥в, скласти електронн≥ р≥вн€нн€, розставити коеф≥ц≥Їнти в р≥вн€нн€х окисно-в≥дновних реакц≥й. ¬изначити окисники та в≥дновники, обчислити мол€рн≥ маси екв≥валент≥в окисник≥в та в≥дновник≥в. ¬изначити тип окисно-в≥дновноњ реакц≥њ.
¬ар≥анти завдань
1. NaBr + MnO2 + H2SO4 → MnSO4 + Na2SO4 + Br2 + Ќ2ќ;
2. HNO3 + Zn → Zn(NO3)2 + NH4NO3;
3. H2SO3 + K2Cr2O7 + H2SO4 → Cr2(SO4)3 + K2SO4 + Ќ2ќ;
4. KI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 + K2SO4 + Ќ2ќ;
5. HNO3 + As2S3 →H3AsO4 + H2SO4 + NO;
6. KClO3 + FeSO4 + H2SO4 → KCl + Fe2(SO4)3 + H2O;
7. KBrO + MnCl2 + KOH → KBr + MnO2 + KCl + H2O;
8. Zn + HNO3 → Zn(NO3)2 + N2 + H2O;
9. K2SO3 + KMnO4 + KOH → K2SO4 + K2MnO4 + H2O;
10. K2Cr2O7 + H2S + H2SO4 → Cr2(SO4)3 + S + K2SO4 + H2O.






