ѕри посто€нных давлении и температуре люба€ химическа€ реакци€, в том числе и ќ¬–, протекает самопроизвольно в направлении уменьшени€ изобарного потенциала, то есть в том направлении, в котором ∆G<0. »звестно, что -∆G = A′ макс = nFE, где A′ макс Ц максимально полезна€ работа, которую может совершить система при протекании ќ¬–, n Ц число молей электрохимических эквивалентов при совершении ќ¬–, F Ц число ‘араде€ 96484  96500 л/моль, E Ц Ёƒ— гальванического элемента при протекании ќ¬–. “ак как A′ макс >0, то E =
96500 л/моль, E Ц Ёƒ— гальванического элемента при протекании ќ¬–. “ак как A′ макс >0, то E =  ,
,  - скачок потенциала полуреакции, окислитель которой стоит в левой части уравнени€ ќ¬–,
- скачок потенциала полуреакции, окислитель которой стоит в левой части уравнени€ ќ¬–,  - скачок потенциала полуреакции, окислитель которой стоит в правой части уравнени€ ќ¬–.
- скачок потенциала полуреакции, окислитель которой стоит в правой части уравнени€ ќ¬–.
¬ качестве примера вы€сним, будет ли ќ¬–
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
протекать самопроизвольно слева направо. ѕрежде всего вы€сним, какое вещество €вл€етс€ окислителем и восстановителем при протекании ќ¬– в рассматриваемом направлении. »з указанных ниже степеней окислени€ в ќ¬–
10Fe+2SO4 + 2KMn+7O4 + 8H2SO4 = 5Fe2+3(SO4)3 + K2SO4 + 2Mn+2SO4 + 8H2O
видно, что при протекании этой ќ¬– слева направо окислителем €вл€етс€ KMnO4, восстановителем Ц FeSO4; при протекании ќ¬– справа налево окислитель Ц Fe2(SO4)3, восстановитель MnSO4. —оответствующими табличными полуреакци€ми с указанием стандартных потенциалов будут
MnO4- + 8H+ + 5e = Mn+2 + 8H2O 
Fe+3 + 1e = Fe+2 
ѕоскольку  >
>  , постольку Ёƒ— дл€ гальванического элемента на основе протекани€ рассматриваемой ќ¬– будет положительной, если перва€ полуреакци€ протекает слева направо, а втора€ - справа налево. «начит, рассматриваема€ ќ¬– самопроизвольно протекает слева направо.
, постольку Ёƒ— дл€ гальванического элемента на основе протекани€ рассматриваемой ќ¬– будет положительной, если перва€ полуреакци€ протекает слева направо, а втора€ - справа налево. «начит, рассматриваема€ ќ¬– самопроизвольно протекает слева направо.
ќЌ“–ќЋ№Ќџ≈ ¬ќѕ–ќ—џ » «јƒјЌ»я
Ќа основе полуреакций расставьте коэффициенты в уравнени€х реакций. ƒл€ каждой реакции укажите, какое вещество €вл€етс€ окислителем, какое - восстановителем, какое вещество окисл€етс€, какое - восстанавливаетс€, какова Ёƒ— реакций. —делайте выводы.
212. Cr(OH)3↓+KClO+KOH↔K2CrO4+KCl+H2O;
Na2SO3+KMnO4 + H2SO4↔ MnSO4+Na2SO4 + K2SO4 + H2O.
213. K2S + KMnO4 + H2SO4 ↔ MnSO4 + S + K2SO4 + H2O;
K2S + K2Cr2O7 + H2SO4 ↔ Cr2(SO4)3 + S + K2SO4 + H2O.
214. MnO2+KClO3+KOH↔K2MnO4+KCl+H2O;
Cr2(SO4)+ S+K2SO4+H2O↔K2Cr2O7+H2S+H2SO4.
215. Br + KOH → KBrO3 + KBr + H2O;
Si + NaOH + H2O → Na2SiO3 + H2.
216. K2Cr2O7 + H2S + H2SO4 → Cr2(SO4)3 + S + K2SO4 + H2O;
H2O + F2→2HF + O2.
217. ¬+ HNO3→ Ќ3¬ќ3 + NO2;
HIO3 + H2S → I2 +S+ Ќ2ќ.
Cr+HNO3(раз.) → N2+Е
218. Si + NaOH + H2O → Na2SiO3 + H2;
Al + NaOH + H2O →Е
Cl2 + NaOH + H2O → NaClO +NaCl + H2O.
219. SnCl2+Br2+2HCl↔SnCl4+2HBr;
H3PO4+NO↔P+HNO3+H2O.
220. NaNO2 + KMnO4 + H2SO4→ NaNO3 + MnSO4 + K2SO4 + H2O;
NaNO2 + KMnO4 + KOH↔K2MnO4+ NaNO3 +H2O.
221. Al +KMnO4+H2SO4→Al2(SO4)3 + MnSO4 + K2SO4 + H2O;
Zn + KMnO4 + H2SO4→ ZnSO4 + MnSO4 + K2SO4 + H2O.
|
|
|
222. Ќ2S+KMnO4+H2SO4 ↔ K2SO4+S+MnSO4+H2O;
PbSO4+H2O↔Pb+PbO2+H2SO4.
223. Ќ2S + K2Cr2O7 + H2SO4→ S + Cr2(SO4)3 + K2SO4 + H2O;
FeSO4 + K2Cr2O7 + H2SO4→ Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O.
224. Zn + KCIO3 + KOH ↔ K2ZnO2 + KCI + H2O;
MnO4 + KNO2 + KOH ↔ K2MnO4 + KNO3 + H2O.
Pb+HCl→
225. PbSO4 + H2O ↔ Pb + PbO2 + Ќ2SO4;
H2O2 + K2Cr2O7 + Ќ2SO4 ↔ Cr2(SO4)3 + O2 + K2SO4 + H2O.
226. KNO3+Al+KOH+ H2O ↔ KAlO2 + NH4OH;
MnO2+HCl ↔ MnCl2+Cl2+ Ќ2ќ.
227. Zn + KCIO3 + KOH ↔ KCI + K2ZnO2 + H2O;
Zn + KCIO3 + H2SO4↔ KCI + ZnSO4 + H2O;
Cu + HCI + HNO3 →...
228. KJ + KMnO4 + H2SO4 → J2 + MnSO4 + K2SO4 + H2O;
KCI + KMnO4 + H2SO4 → CI2 + MnSO4 + K2SO4 + H2O.
229. KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOH;
KMnO4 + Na2SO3 + H2SO4→ MnSO4 + Na2SO4 + K2SO4 + H2O.
230. K2Cr2O7 + HCI ↔ CI2↑ + CrCI3 + KCI + H2O;
K2MnO4 + H2O ↔ KMnO4 + MnO2↓ + KOH.
231. ака€ из приведенных ниже реакций будет идти более интенсивно? ѕочему?
—r + NaOH + H2O→Е;
Al + NaOH + H2O→...
232. аким из окислителей (KMnO4 или K2Cr2O7) лучше воспользоватьс€ дл€ получени€ хлора из HCl?
φ MnO4-/Mn+2=+1,52 B.
φ Cr2O72-/2Cr+3=+1,33 B.
φCl2/2Cl-=+1,36B.
233. ƒайте анализ следующих окислительно-восстановительных реакций: а) Fe + HNO3(разб) Ѓ; б) Fe + HNO3 (конц.) Ѓ;
234. дайте анализ следующих окислительно-восстановительных реакций:
а)Zn + HNO3 (разб); б)Zn+ HNO3 (конц); в)Fe + HNO3(конц).
235. ƒайте анализ следующих окислительно-восстановительных реакций: а) Al + HNO3 (разб); б) Al + HNO3 (конц); в) Al + H2SO4 (конц).
√альванические элементы
√альванические элементы Ч устройства, в которых химическа€ энерги€ превращаетс€ в электрическую, т.е. гальванический элемент служит источником электрохимической энергии. √аль≠ванический элемент состоит из двух физически разделенных полуреакций окислительно-восстановительного процесса, назы≠ваемых полуэлементами (рис. 1).
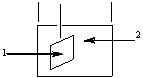
–ис. 1. ѕолуэлемент гальванического элемента:
1 Ч металлическа€ пластина; 2 - раствор соли металла
¬ зависимости от состо€ни€ металл характеризуетс€ потенциалами: Me0 Ц ≈1, ће +n (р-р)- ≈2. ¬ полуэлементе устанавливаетс€ равновесие:
ће+ n (р-р) + nē = Me0.
ћежду ће0 и ће+ n (р-р) возникает разность потенциалов Ч электродный потенциал (≈):
≈ = ≈1 - ≈2.
Ёлектродный потенциал зависит от природы металла, концентрации катионов металла в растворе (—ће+ n) и температуры (“, ) Ц уравнение Ќернста:

или, дл€ “ =298 :

где ≈ - нормальный потенциал металла при стандартных услови≠€х: “= 298 , —ће+ n =1 моль/л; n Ч валентность; —ће+ n Ч концентра≠ци€ ионов металла, моль/л, рассчитываема€ по формуле: —ће+ n = = —ЈαЈ (— Ч концентраци€ соли, моль/л; α Ч степень диссоциации электролита, долей единицы; Ч число ионов данного вида, обра≠зуемых одной молекулой электролита при диссоциации).
ќпределить абсолютное значение ≈ не представл€етс€ воз≠можным, но можно найти разность электродных потенциалов двух полуэлементов. ƒл€ этого один полуэлемент соедин€ют со вторым полуэлементом с помощью металлического проводника и сол€ного мостика, при этом получаетс€ гальванический эле≠мент, где электроны перемещаютс€ по внешней цепи, т.е. элек≠трическа€ цепь замыкаетс€ (рис. 2).
|
|
|

–ис. 2. √альванический элемент:
I, II - полуэлементы; 1,2 - пластинки из двух металлов (электроды);
3,4- растворы, содержащие катионы металлов; 5 - сол€ной мостик;
6 - металлический (электронный) проводник
¬ полуэлементах могут протекать процессы:
I Me∞I - nē → ће +n I (р-р) (окисление)
II ће +n II (р-р) + nē →ће∞II (восстановление)
Ёлектродные потенциалы полуэлементов:
≈ I = ≈I ,1 - ≈ I ,2; ≈ II = ≈ II,1 - ≈ II ,2.
ћежду соединенными в цепь электродами возникает напр€жение V, которое €вл€етс€ мерой его способности совер≠шать работу переноса электронов от Me I к ће II:
V=E I -E II.
Ќапр€жение €вл€етс€ мерой энергии, с которой происходит окислительно-восстановительна€ реакци€:
Me∞I + ће +n II→ће +n I + Me∞II.
¬осстано- ќкисли-
витель тель
—ледовательно, V- Ёƒ— гальванического элемента.
“аким образом, определив опытным путем значение V, можно вычислить один электродный потенциал, если известен другой.
ќбычно полуэлемент (полуреакци€) сопоставл€ют с условным эталоном, потенциал которого принимаетс€ за нулевой. ¬ качестве такового прин€то рассматривать водородный электрод (рис. 3).

–ис. 3. —тандартный водородный электрод:
1 - пластинка из Pt; 2 - трубка дл€ подачи Ќ2
(PH2 = 101 кѕа, T=298 ); 3 - раствор H+ ([Ќ+] = 1 моль/л)
¬ приведенном полуэлементе имеет место равновесие
Ќ2 Ђ2 Ќ+ + 2ē.
ѕотенциал электрода принимаетс€ за нуль: ≈∞ 2H+/H2=0,0.
ƒл€ случа€, когда [Ќ+] ≠ 1 ,≈= 0,059 Ig [Ќ+]¬=59 Ig [Ќ+] м¬. »ме€ известный потенциал одного электрода (≈∞ 2H+/H2), можно включить его в гальваническую цепь с другим, измерить V, а затем рассчитать ≈∞ ће+ n /ће0.
¬ качестве примера рассмотрим гальванический элемент, составленный из цинкового электрода, опущенного в раствор, содержащий 1 моль/л Zn+2, t = 25 ∞—, и стандартного водородного электрода (рис. 4). ’имическа€ цепь гальванического элемен≠та записываетс€ так:
Zn/Zn+2 (1ћ) ║ Ќ2 (101 кѕа)/Ќ+(1 ћ).
ќпытным путем установлено, что в приведенном элементе V=0,766B.

–ис.4. √альванический элемент Zn/Zn+2║Ќ2/Ќ+
Ёлектроны во внешней цепи направлены от Zn (этот элек≠трод рассматриваетс€ как отрицательный) к Ќ2 (этот электрод прин€то считать положительным):
(-) Zn / Zn+2 ║ Ќ2, Pt / 2 Ќ+ (+).
Ёлектрод-восстановитель Ёлектрод-окислитель
ѕри вычислении V гальванического элемента прин€то из по≠тенциала положительного электрода (окислител€) вычитать по≠тенциал отрицательного электрода (восстановител€). —ледова≠тельно: V=≈∞ H2/2H+ - ≈∞ Zn/Zn+2, тогда ≈∞ Zn/Zn+2= ≈∞ H2/2H+ -V = 0-0,76 ¬ = - 0,76 ¬.
ѕроцесс, протекающий в рассмотренном гальваническом элементе:
Zn + 2 Ќ+ = Zn +2 + Ќ2.
ƒл€ гальванического элемента:
(+) —u / —u+2(1 ћ) || Ќ2 (101 кѕа), Pt / 2Ќ+ (1ћ) (-) найдено, что V= 0,34 ¬, а электроны направлены от Ќ2 (-) к —u(+).
¬ этом случае паление напр€жени€ V=≈∞ —u/—u+2 -≈∞ H2/2H+, а потенциал медного электрода: ≈∞ —u/—u+2= V + ≈∞ H2/2H+=0,34 ¬+0=+0,34 ¬.
ѕроцесс, протекающий в гальваническом элементе:
Cu+2 + Ќ2 = —u + 2Ќ+.
ѕри расположении металлов в пор€дке увеличени€ алгеб≠раических значений их нормальных потенциалов получаетс€ р€д напр€жений металлов.
ќЌ“–ќЋ№Ќџ≈ ¬ќѕ–ќ—џ » «јƒјЌ»я
236. ќпределите значение электродных потенциалов:
а) —u / (0,001 моль /л) —u+2
б) Ag / (0,01 моль /л) AgNO3;
в) ј1 / (0,005моль /л) Al2 (SO4)3.
237. ¬ычислите электродный потенциал —u / 0,1 M CuSO4, если α(CuSO4) = 40 %.
238. Ёлектродный потенциал Zn/0,1ћ ZnS04 равен 0,8013¬. „ему равна α (ZnSO4) в растворе?
239. ќпределите значени€ потенциалов водородного элек≠трода Pt, Ќ2 /2H+, м¬, при [Ќ+], моль /л: 0,1; 0,01; 0,001; 0,0001; 0,00001.
240. ѕотенциал электрода Pt, H2/раствор HCl неизвестной концентрации равен 118 м¬. ќпределите концентрацию раство≠ра Ќ—l (моль /л и мг/мл).
241. ¬ычислите потенциал серебр€ного электрода в насы≠щенном растворе AgBr (ѕ– = 6Ј10-8), содержащем, кроме того, 0,1 моль /л ¬r.
|
|
|
242. ¬ычислите значени€ электродных потенциалов дл€ со≠пр€женной пары Fe3+/Fe2+, дл€ значений, моль/л:
а) [Fe3+] = 10-1; [Fe2+] =10-4
б) [Fe3+] = 10-4; [Fe2+] =10-1.
243. ’имические цепи, представленные в молекул€рной форме, запишите в ионной форме:
а) Zn / ZnSO4║ CuSO4 /—u;
б) Fe / FeCl║ Ќ3–ќ4 / Ќ2, Pt.
244. ÷епи, записанные в ионной форме, замените примера≠ми соответствующих цепей, представленных в молекул€рной форме:
а) Hg / Hg+2 ║ Mn+2 / Mn;
б) Fe / Fe+3 ║ Au+3 /Au; ' ■
в) Ќ2/2Ќ+ ║Ag+/Ag.
245. ”кажите знаки полюсов, направление потока электро≠нов и Ёƒ— цепи:
—u / 0,1 ћ CuSO4 || 0,1 ћ ZnCl2 / Zn.
α= 40 % α= 73 %
246. Ёƒ— цепи: —u / [CuSO4]=X║ 0,1 ћ Zn+2 / Zn равна 1,04¬. ќпределите концентрацию ионов меди, моль/л.
247. Ѕудет ли работать гальванический элемент на реакции Mn + Ni+2→Mn+2 + Ni?
248. √альванические элементы составлены по схемам:
а) Fe+3/ Fe+2║Ag+ / Ag;
б) —lO3 +6 Ќ+/—l- +3H2O ║ 2I- / I2.
–ассчитайте Ёƒ— этих элементов при стандартных услови€х; найдите ΔG∞298.
249. ќпределите направление реакции 2Hg+2Ag+↔2Ag + Hg2+2:
а) при [Ag+] = 10-1 моль/ л; [Hg2+2] = 10-1 моль/л;
б) при [Ag+] = 10-1 моль/л; [Hg2+2] =10-4 моль/л,
250. ќпределите, в каком направлении пойдут реакции:
а) 2Fе+3 + 2I- = 2Fe+2 + J2;
б)2Fe+3 + 2—l- = 2Fe+2 + CI2;
в) CI2 + 2I- = 2—l- + J2.
251. ћожно ли окислить Mn+2 до ћnO4- персульфатов кали€?
252. Ќайдите электродные потенциалы системы:
ћnO4- + 8Ќ+ = ћn+2 + 4Ќ2O при рЌ = 6;3; 1.
253. √альванический элемент состоит из металлического Zn, погруженного в 0,1 ћ раствор Zn(NO3)2, и металлического –b, погруженного в 0,002 ћ раствор –b(NO3)2. ¬ычислите Ёƒ— элемента, запишите уравнени€ электродных процессов, составь≠те схему элемента.
Ёлектролиз
Ёлектролиз включает в себ€ электрохимические окислительно-восстановительные реакции, протекающие на электродах, помещенных в раствор или расплав электролита, при прохождении через них электрического тока, поэтому эти процессы можно назвать реакци€ми окислени€ и электровосстановлени€. Ёлектролиз провод€т в специальных приборах - электролизерах. ќсновные составные части электролизной €чейки - ванна, заполненна€ раствором или расплавом электролита; два электрода, опущенные в электролит и источник посто€нного тока. ¬ качестве электродов примен€ютс€ платиновые и угольные (графитовые) стержни. ¬ электролизерах при электролизе электрическа€ энерги€ превращаетс€ в химическую.
–аботающа€ электролизна€ €чейка Ц неравновесна€ электрохимическа€ система. ¬ ней протекают следующие электрохимические процессы:
1. јнодный - электрохимическое окисление анионов или растворимого анода Ц металла. ¬ общем виде
јнод(+) ¬‘- пē →ќ‘,
осуществл€етс€ окисление частицы, наход€щейс€ в восстановленной форме (¬‘) и переход еЄ в окисленную форму (ќ‘). јнод электролизера соединен с положительным полюсом источника тока.
2. атодный Ц электрохимическое восстановление частиц, наход€щихс€ в окисленной форме. ¬ общем виде
атод (-) ќ‘+ пē →¬‘.
атод электролизера соединен с отрицательным полюсом источника тока.
3. ѕод действием электрического тока происходит движение электронов во внешней цепи и движение ионов Ц во внутренней. ¬нешний источник тока выполн€ет роль насоса, который перекачивает электроны с анода на катод, интенсивность перекачивани€ зависит от внешнего напр€жени€ тока.
ѕроцессы, протекающие при электролизе, противоположны процессам, протекающим в гальванических элементах.
Ёлектрохимические окислительно-восстановительные реакции можно осуществить в ходе электролиза только при затрате электрической энергии от внешнего источника тока.
|
|
|
Ёлектролиз расплавов
јлгоритм составлени€ схемы электролиза расплавов
1. ¬озможный сложный состав расплава
NaCl→ Na+ + Cl-, NaBr→ Na+ + Br-;
ZnCl2 → Zn2+ + 2Cl- ;
CuCl2 → Cu2+ + 2Cl-.
2. –аспределение ионов
а) Cu2+ , Zn2+, Na+ - катод (-);
б) Cl-, Br- - анод (+).
3. –азр€д ионов. ¬озможные процессы:
а) на катоде: Cu2++2 ē →Cu, ≈=0,34 ¬;
Zn2++2 ē →Zn, ≈=-0,76 ¬;
Na+ + ē → Na, ≈=-2,71 ¬;
б) на инертном аноде: 2Cl--2 ē →—12, ≈=1,36 ¬;
2 Br--2 ē →Br2, ≈=1,07 ¬.
¬ первую очередь разр€жаютс€:
а) на катоде (процесс восстановлени€):
Cu2++2 ē →Cu, т.к. ≈ Cu2+/ Cu > ≈ Zn2+/ Zn> ≈ Na+ /Na;
б) на аноде (процесс окислени€): 2 Br--2 ē →Br2, т. к. ≈ Br-/ Br2< ≈ Cl- /—12;
4. јнод растворимый (Zn, Cd, Cu)- окисл€етс€ металл анода, например электролиз CuSO4 с медным анодом. —хема электролиза:
катод(-) Cu2++2 ē →Cu;
анод(+) Cu-2 ē →Cu2+.
5. »тоговое уравнение
| восстановитель 1 окислитель 1 | 2 Br--2 ē →Br2; Cu2++2 ē →Cu; |
| Cu2++2 Br-→ Cu+ Br2. |
»онное уравнение:
CuCl2 + NaBr→ Cu2+ + 2Cl- + Na+ + Br-→ Cu + Br2 + 2Cl- + Na+.
Ёлектролиз растворов
јлгоритм составлени€ схем электролиза растворов (электроды инертные и анод растворимый)
1. ¬озможный сложный состав раствора
а) (Li+-Al3+) Ц металлы активной группы (≈ = от-1,02 до- 1,67);
б) (Mn2+-H+) Ц металлы средней активности (≈ = от-1,05 до-0,5);
в) (Bi3+-Au3+) Ц металлы неактивной группы (≈= от 0,00 до +1,5);
г) Ќ2ќ (≈ =0,4¬)
д) анионы типа Cl-, Br-, J-, S2-,OH-, H2O, SO42-, PO43- и др.
”читываем направление движени€ ионов в электролизе. Ќапример, катионы направл€ютс€ к катоду (-), а анионы Ц аноду (+).
2. ѕор€док возможных катодных процессов: здесь учитывают, что на электроде восстанавливаетс€ более сильный окислитель; или ионы ће п+ или Ќ+(Ќ2ќ) → Ќ2↑+ќЌ-,
≈ Ќ+(Ќ2ќ)/Ќ2 = -0,41¬.
а) катионы металлов активной группы
ће п++ 2Ќ2ќ+2 ē → Ќ2↑+ ће п++ 2ќЌ-, т. к.
≈ ће п+ /ће << ≈ Ќ+/Ќ2=-0,41¬;
¬ыход ће по току η=0;
б) катионы металлов группы средней активности
ће п+ + п ē →ће↓;
2Ќ2ќ+2 ē → Ќ2↑+2ќЌ-, т. к. ≈ ће п+ /ће≈ ≈ Ќ2ќ/Ќ2= -0,41¬;
¬ыход ће по току η>0<100%(~50%);
в) катионы металлов неактивной группы: ће п+ + п ē →ће↓, т.к.
≈ ће п+ /ће> ≈ Ќ2ќ/Ќ2=-0,41¬. ¬ыход ће по току η=100%.
Ќа аноде окисл€етс€ более сильный восстановитель. „ем проще по составу частица, тем она легче разр€жаетс€ на аноде. »сключение составл€ет ион F-.
3. јнодные процессы на инертном электроде (Cграфит, Pt, Jr, Au):
а) в первую очередь разр€жаютс€ анионы бескислородных кислот Ц S2-, J-, Br-, Cl-, CN-;
б) анионы кислородосодержащих кислот (NO3-,PO43-, SO42-) не окисл€ютс€, а происходит процесс окислени€: 2Ќ2ќ-4 ē →ќ2+4Ќ+, ≈ќЌ /ќ2-= 0,82.
4. јнодный процесс на растворимом электроде (Zn, Cd, Cu, и т. д.). ѕри этом происходит окисление (растворение) анода, например: Zn-2 ē →Zn2+ или Cu-2 ē →Cu2+.
5. —оставл€ем итоговое уравнение электролиза, суммиру€ реально протекающие процессы, например, дл€ водного раствора соли Na2SO4 (инертные электроды):
анод (+) 1| 2Ќ2ќ-4 ē → ќ2↑+4Ќ+ - процесс окислени€
катод (-) 1| 2Ќ2ќ+2 ē → Ќ2↑+2ќЌ- - процесс восстановлени€
__________________________________________________
2Ќ2ќ+4 Ќ2ќ→ ќ2↑+ Ќ2↑+4Ќ++4ќЌ- (ионное уравнение)
2Ќ2ќ→ ќ2↑+2 Ќ2↑ (молекул€рное уравнение)
6. ѕор€док имеет ориентировочный характер. Ќа практике приходитс€ учитывать услови€ электролиза:
а) дл€ реакции в расплавах электродные потенциалы имеют другие значени€, чем потенциалы “ќ¬ѕ;
б) концентрации реагирующих веществ измен€ютс€ в процессе электролиза, что приводит к изменению электродных потенциалов;
в) рЌ раствора (≈ Ќ2ќ/Ќ2=-0,59¬);
г) материал катода (≈ Ќ2ќ/Ќ2(Pt)= -0,41¬ и ≈ Ќ2ќ/Ќ2(—)= -0,41¬. η Ќ2(—) =-0,41-0,65);
д) плотность тока.
ѕримеры электролиза солей (водных растворов)
ѕример 1. Ёлектролиз NaCl с графитовыми электродами. —оль NaCl гидролизу не подвергаетс€, среда нейтральна€.
—хема электролиза:
катод (-) 2Na++2H2O+2 ē → Ќ2↑+2ќЌ-+2Na+
анод (+) 2Cl--2 ē →Cl2↑
2NaCl+2NaOH→ Ќ2↑+ Cl2↑+2NaOH
ѕродукты электролиза: Ќ2↑, Cl2↑, NaOH (катодна€ и анодна€ зоны разделены). ¬ услови€х свободного перемещени€ продуктов возможно их взаимодействие:
|
|
|
Cl2+2NaOH→NaCl+NaClO3+H2O;
2Cl2+6NaOH→10NaCl+2NaClO3+6H2O.
ѕример 2. Ёлектролиз KNO3 с графитовыми электродами. —оль KNO3 гидролизу не подвергаетс€, среда нейтральна€. —хема электролиза:
атод(-) 2K++2H2O+2 ē → Ќ2↑+2ќЌ-+2K+
јнод(+) 2NO3-+Ќ2ќ-2 ē →1/2ќ2↑+2Ќ++2NO3-
______________________________________
Ќ2ќ→Ќ2+1/2ќ2↑
ѕродукты электролиза: Ќ2, KOЌ, ќ2, HNO3, (катодна€ и анодна€ зоны разделены); Ќ2, ќ2 (электролиз проводитс€ без диафрагмы).
ќбратите внимание, что ни ионы +, ни ионы NO3- не разр€жаютс€ на электродах. Ёлектролиз солей типа KNO3 сводитс€ к разложению воды.
ѕример 3. Ёлектролиз ZnCl2 с графитовыми электродами. —оль ZnCl2 гидролизуетс€ по катиону, среда кисла€.
катод (-) Zn2++2 ē → Zn↓; | 1
2H++2 ē → Ќ2↑; |
анод (+) 2Cl--2 ē → Cl2↑; | 2
ZnCl2 + 2HCl → Zn↓ + Ќ2↑ + Cl2↑.
атодные продукты: Zn, Ќ2; анодный Cl2.
ѕример 4. Ёлектролиз CuSO4 медным анодом. —хема электролиза:
катод (+) Cu2++2 ē →Cu↓;
анод (+) Cu-2 ē →Cu2+.
¬ процессе электролиза с растворимым анодом происходит перенос меди с анода на катод. Ётот процесс используетс€ при очистке-рафинировании меди (электролитическа€ очистка).
оличественные расчеты при электролизе
1. Ќапр€жение разложени€ ≈разл Ц минимальное напр€жение, которое необходимо непрерывно поддерживать на электродах дл€ того, чтобы электролиз протекал с заметной скоростью.
ƒл€ вычислени€ напр€жени€ разложени€ нужно знать электродные потенциалы: ≈(+) Цравновесный потенциал анодного процесса; ≈(-) Ц равновесный потенциал катодного процесса (“ќ¬ѕ).
Ќапр€жение разложени€ равно Ёƒ— внутреннего (пол€ризационного) гальванического элемента (√Ё), который возникает в процессе электролиза:
≈разл = Ёƒ—вн.гэ = ≈(+) - ≈(-)
Ќапример, напр€жение разложени€ водного раствора хлорида меди вычисл€етс€ как Ёƒ— медно-хлорного гальванического элемента:
≈разл = Ёƒ—вн.гэ = ≈(+) - ≈(-) = 1,36-0,34=1,02¬
—хема электролиза:
катод (+) Cu2++2 ē →Cu↓;
анод (+) 2Cl--2 ē → Cl2↑;
_______________________________
Cu—l2 → Cu ↓ + Cl2↑.
ѕродукты электролиза: Cu и Cl2.
ћежду одинаковыми графитовыми электродами, погруженными в один и тот же раствор хлорида меди, разность потенциалов равна нулю. ѕри пропускании тока химическа€ природа электродов измен€етс€. ќдин электрод становитс€ медным, а другой Ц хлорным. ¬ электролизере возникает электрический ток обратного направлени€, как следствие работы медно-хлорного гальваноэлемента.
—хемы работы внутреннего (пол€ризационного) гальваноэлемента:
Cu | Cu2+ || Cl- | Cl2 (—).
←јn n -
¬ процессе его работы на электродах идут следующие реакции:
≈ Cu2+/Cu = +0.34¬ (-): Cu-2 ē →Cu2+ (анодна€ реакци€);
≈ Cl2/Cl- = +1,36¬ (+): Cl2+2 ē → Cl- (катодна€ реакци€);
__________________
Cu + Cl2→ CuCl2 (токообразующа€ реакци€).
¬нутренний гальваноэлемент возник как следствие химической пол€ризации электродов Ц пол€ризации при электролизе.
ќбратите внимание, что электродные реакции при работе гальваноэлемента и в процессе электролиза пр€мо противоположны. ¬нутренний гальваноэлемент тормозит процесс электролиза. ƒл€ подавлени€ его работы на электролизер следует подать напр€жение, численно равное Ёƒ—, но противоположного направлени€.
–еально напр€жение между электродами работающего электролизера (напр€жение на электролизере), выше, чем Ёƒ— вн. гэ за счет пол€ризации и омических сопротивлений электролита, диафрагмы, электродов и т.п. Ќапр€жение на электродах рассчитываетс€ по формуле
≈ разл.практ = ≈ разл +Δ ≈ пол€р + IR + Σ ≈ конт,
где ≈ разл - Ёƒ— вн. гэ (составл€юща€ химической пол€ризации);
Δ ≈ пол€р- пол€ризаци€ анода и катода (концентрационна€ и активационна€, т.е. перенапр€жение); I Ц сила тока при электролизе; R Ц сопротивление системы; Σ ≈ конт Ц сумма контактных потенциалов.
—огласно формуле Δ ≈ пол€р = ≈ конц + ≈ акт и учитыва€, что Δ ≈ конц мало, можно выразить Δ ≈ пол€р через перенапр€жение (Δ ≈ пол€р= η).
ѕеренапр€жение при электролизе можно рассматривать как некоторое дополнительное напр€жение, которое необходимо приложить к электролизеру сверх теоретического значени€ напр€жени€ разложени€, чтобы обеспечить бесперебойное протекание электролиза.
“еоретический расчет ≈ разл.практ обычно ненадежен (из-за р€да факторов, не поддающихс€ точному учету), поэтому ее определ€ют экспериментально.
2. «акон ‘араде€. ћасса электролита, подвергша€с€ разложению электрическим током, а также массы веществ, выделившихс€ на электродах, пр€мо пропорциональны количеству протекшего через электролит электричества и эквивалентным массам вещества:
m=Ё I t /F,
где m Ц масса электролита, подвергша€с€ разложению, или массы веществ Ц продуктов электролиза, г; Ё Ц эквивалентна€ масса вещества, дл€ которого рассчитываетс€ m, г/моль; I Ц сила тока, ј; t Ц продолжительность электролиза, с; F Ц число ‘араде€, равное 96500 л/моль
ƒл€ газообразных продуктов рассчитывают объем
 V=VЁ I t
V=VЁ I t
96500
где V Ц объем выделившегос€ газа; VЁ - эквивалентный объем.
3. ¬ыход по току (коэффициент выхода по току) - отношение массы полученного вещества к массе, теоретически вычисленной на основании закона ‘араде€:
h=(m практ / m теор) 100,
где h Ц выход по току, %; m практ Ц масса вещества, реально полученного при электролизе; m теор Ц масса, вычисленна€ по закону ‘араде€.
¬ыход по току вещества всегда меньше 100%, т.к. нар€ду с основными электродными реакци€ми протекают побочные или параллельные.
ѕример 5. Ќапишите уравнени€ электродных реакций при электролизе расплава NaOH. ”читыва€ возможность перемешивани€ электродных продуктов, напишите уравнение их взаимодействи€, снижающее выход катодного продукта на 50%. ¬ анодной или катодной зоне это взаимодействие опасно? ¬ какой благопри€тно? ќтвет обоснуйте.
–ешение. ¬ расплаве NaOH два вида ионов Na+ и ќЌ-.—хема электролиза:
катод (-) 2Na+ +2 ē → 2Na;
анод (+) 2ќЌ--2 ē →1/2ќ2↑+ Ќ2ќ;
_____________________________________________
2 NaOH→ 2Na+1/2ќ2↑+ Ќ2ќ.
¬ода и натрий взаимодействуют по уравнению
Na + Ќ2ќ→NaOH+1/2Ќ2↑.
—ледовательно, половина полученного на катоде натри€ может быть снова израсходована. ¬ыход по току натри€ 50%.
≈сли взаимодействие продуктов происходит у анода, где образуетс€ кислород, то возможны взрывы гремучей смеси (Ќ2 и ќ2). ѕри взаимодействии продуктов в катодной зоне выдел€ющийс€ водород создает восстановительную атмосферу и защищает натрий от окислени€ кислородом.
ѕример 6. Ќапишите уравнени€ реакций, протекающих на электродах при электролизе раствора CdSO4 (электроды графитовые). акой внутренний гальванический элемент при этом образуетс€ и какова его роль? –ассчитайте напр€жение разложени€.
–ешение. —оль (CdSO4→Cd2++ SO42-) гидролизуетс€ по катиону, и ее раствор имеет слабокислую реакцию. ѕренебрега€ гидролизом, можно считать рЌ=7.
адмий Ц металл средней активности. Ќа катоде идут два параллельных процесса, т.к. ≈ Cd2+/ Cd ≈ ≈ Ќ2ќ / Ќ2 (рЌ=7):
катод (-) Cd2++2 ē → Cd↓;
2H2O+2 ē → Ќ2↑+2ќЌ-.
јнион SO42- сложнее по составу, чем H2O, окисл€етс€ труднее. Ќа аноде выдел€етс€ ќ2:
анод (+) SO42- + 2H2O - 4 ē → ќ2↑ + 4Ќ+ + 2ќЌ- + SO42-
—уммарное уравнение:
CdSO4+ 2H2O→ Cd↓ + Ќ2↑+ ќ2↑+2 Ќ2SO4.
Ёлектролиз солей типа CdSO4 ведут с целью выделени€ металла. —ледовательно, основными продуктами электролиза в этом случае €вл€ютс€ кадмий и кислород. ¬ процессе электролиза измен€етс€ химическа€ природа электродов. ¬место одинаковых графитовых электродов (Δ ≈ =0) образовались разные: кадмиевый и газовый - кислородный, подкладкой которого €вл€етс€ графит. ¬озник кислородно-кадмиевый гальванический элемент. —хема работы внутреннего гальваноэлемента:
Cd | Cd2+ || H2O | ќ2 (—);
←јn n -
анод (-) Cd-2 ē → Cd2+;
катод (+) 1/2ќ2+ 2Ќ++2 ē → Ќ2ќ.
¬нутренний гальваноэлемент тормозит процесс электролиза, т.к. вызывает прохождение процессов, противоположных тем, которые идут на электродах электролизера.
Ќапр€жение разложени€ ≈ разлрассчитываетс€ как Ёƒ— внутреннего гальваноэлемента:
≈ разл=Ёƒ—вн.гэ= ≈(+)-≈ (-)=0,82-(-0,4) =1,22¬.
ѕример7. ѕри электролитическом рафинированиикобальта аноды, содержащие, помимо кобальта, никель, железо, медь, в услови€х процесса полностью окисл€ютс€. “ребуетс€ ли очистка электролита от указанных примесей дл€ получени€ чистого катодного кобальта? ќтвет обоснуйте. Ќапишите уравнени€ соответствующих реакций.
–ешение. ѕо условию задачи на аноде идут реакции:
анод (+) Fe-2 ē → Fe 2+ E0 Fe2+/ Fe = -0,44 B;
Co-2 ē → Co 2+ E0 Co2+/ Co = -0,28 B;
Ni-2 ē → Ni 2+ E0 Ni2+/ Ni = -0,25B;
Cu-2 ē → Cu 2+ E0 Cu2+/ Cu = +0,34 B.
¬ыделение металлов на катоде происходит в такой последовательности:
Cu 2+ Ni 2+ Co 2+ Fe 2+
+0,34 -0,25 -0,28 -0,44
 |
—пособность к присоединению электронов уменьшаетс€.
ѕри получении чистого кобальта реакци€ должна быть единственной.
катод (-) Co+2 ē → Co ≈ = -0,28
Ёто возможно при отсутствии в электролите более сильных окислителей. —ледовательно, очистка электролита от ионов
Cu 2+, Ni 2+ необходима. »оны Fe 2+ не преп€тствуют получению чистого кобальта при условии Ц0,44 <≈к<-0,23.
ѕример 8. —колько никел€ и водорода выделитс€ на катоде при электролизе кислого раствора хлорида никел€, если процесс ведут в течение часа силой тока 5 ј и выхода по току никел€
60 %?
–ешение.
Ќикель Ц металл средней активности. Ќа катоде идут два параллельных процесса: восстановление ионов никел€ и иона водорода (в кислой среде). Ќа аноде окисл€ютс€ ионы CI-. —хема электролиза:
катод (-) Ni2++2 ē → Ni↓ | 1
2 H+ +2 ē → H2 ↑ |
анод (+) 2CI - 2 ē → CI2 ↑ | 2
_________________
Ni2++2 H+ + 4CI- → Ni↓ + H2 ↑ + 2CI2 ↑
NiCI2 + 2HCI → Ni↓ + H2 ↑ + 2CI2 ↑
¬ычисл€ем массу никел€ по закону ‘араде€ с учетом выхода
по току никел€ (0,6):
m (Ni) = (Ё(Ni)Ј I Ј t Ј h /96500) = (58,7/2 Ј 5 Ј60 Ј 0,6)/96500 = 3,24 г.
¬ычисл€ем объем водорода по закону ‘араде€ с учетом выхода по току водорода (1-0,6 = 0,4): V (H2)= V Ё (H2) Ј I Ј t Ј h / ≈ = 11,2 Ј 5 Ј 60 Ј 0,4/96500 = 0,84 л.
ќЌ“–ќЋ№Ќџ≈ ¬ќѕ–ќ—џ » «јƒјЌ»я
254. ѕри пропускании тока 2 ј в течение 1ч 14 мин 24 с через водный раствор хлорида металла (II) на одном из графитовых электродов выделилось 2,94 г металла. „ему равна атомна€ масса металла, если выход по току 100 %, и что это за металл? Ќапишите уравнени€ реакций, протекающих на электродах. (ќтвет: 63,54 г.)
255. „ерез раствор сульфата кадми€ пропущено 25 ј тока. ѕри этом на катоде выделилось 42,5 г кадми€. Ќапишите уравнени€ реакций, протекающих на электродах. –ассчитайте выход по току кадми€. (ќтвет: 80,5 %.)
256. „ерез раствор сульфата металла (II) пропустили 400 л электрического тока. ѕри этом на катоде выделилось 0,196 г металла. ¬ыход металла по току на катоде равен 80 %. ќпределите металл и составьте уравнени€ реакций, протекающих на электродах: а) дл€ графитовых электродов; б) дл€ металлических электродов.
257. „ерез раствор сульфата железа (II) в течение 1ч пропускали ток силой 13,4 ј. ќпределите массу железа, которое выделилось на катоде, если выход по току был равен 70 %. Ќапишите уравнени€ реакций, протекающих на электродах. (ќтвет: 13,96 г.)
258. ѕри электролизе сульфата натри€ получили при н.у. 448 л водорода. Ќапишите уравнени€ реакций, протекающих на нерастворимых аноде и катоде, и рассчитайте, сколько времени протекал электролиз, если сила тока была 100 ј. (ќтвет: 10,72 ч.)
259. Ёлектролиз раствора сульфата кали€ проводили с нерастворимыми электродами при силе тока 2,68 ј в течение 1ч. —оставьте уравнени€ процессов, происход€щих на электродах, вычислите объем, выдел€ющихс€ на электродах веществ при н.у. (ќтвет: 0,56 и 1,12 л.)
260. ѕри электролизе раствора CuS04 на аноде выделилось 560 мл кислорода, измеренного при н.у. —колько граммов меди выделилось на катоде? (ќтвет: 3,16 г.)
261. Ќапишите уравнени€ реакций, протекающих на нерастворимых электродах при электролизе водного раствора ќЌ. акие вещества и в каком объеме можно получить при н.у., если пропустить ток силой 13,4 ј в течение 2 ч? (ќтвет: 11,2 и 5,6 л.)
262. акие процессы идут на графитовых электродах при электролизе раствора ќЌ? —колько граммов веществ выделитс€ на электродах при пропускании тока силой 6,7 ј, если врем€ электролиза 1ч? (ќтвет: 0,25 и 2 г.)
263. Ќапишите уравнени€ реакций, протекающих на электродах при электролизе водного раствора сульфата никел€. –ассмотрите при этом: а) электроды никелевые, б) электроды нерастворимые. акой должна быть сила тока, чтобы за 10 ч на катоде выделилось 47 г никел€ (при выходе его по току 80 %)? (ќтвет: 5,36 ј.)
264. Ёлектролиз раствора нитрата серебра проводили при силе тока 2 ј в течение 4 ч. —оставьте электронные уравнени€ процессов, происход€щих на электродах. ака€ масса серебра выделилась на катоде и каков объем газа в н.у., выделившегос€ на аноде? (ќтвет: 32,2 г и 1,67 л.)
265. Ёлектролиз раствора NaJ проводили при силе тока 6 ј в течение 2,5 ч. —оставьте электронные уравнени€ процессов, происход€щих на угольных электродах, и вычислите массу ве≠щества, выделившегос€ на катоде и аноде. (ќтвет: 0,56 и 71,0 г.)
266. —оставьте электронные уравнени€ процессов, происхо≠д€щих на угольных электродах при электролизе раствора AgN03. ≈сли электролиз проводить с серебр€ным анодом, то его масса уменьшитс€ на 5,4 г. ќпределите расход тока при этом. (ќтвет: 830 л.)
267. ”кажите, раствор или расплав —а—12 примен€етс€ при электролитическом получении кальци€. «апишите уравнени€ электродных процессов и вычислите, сколько времени потребуетс€ дл€ получени€ 1 кг металла. —ила тока 2000 ј. ¬ыход по току 70 %.
268. Ќапишите электродные уравнени€ при электролизе водного раствора —1 на графитовых электродах. акой внутренний гальванический элемент при этом образуетс€? акова его роль? –ассчитайте напр€жение разложени€.
269. Ќапишите уравнени€ электродных реакций при электролизе раствора NiSќ4. акой внутренний гальванический элемент при этом образуетс€ и какова его роль? –ассчитайте напр€жение разложени€.
270. Ќапишите уравнени€ электродных реакций при электролизе раствора CоSO4. акой внутренний гальванический элемент при этом образуетс€ и какова'его роль? –ассчитайте напр€жение разложени€.
271. Ќапишите уравнени€ электродных реакций при электролизе водного раствора NaOH. акой внутренний гальванический элемент образуетс€ и какова его роль? ¬ычислите напр€жени€ разложени€.
омплексные соединени€
“еори€ строени€ комплексных соединений была предложена в 1893 году ¬ернером и получила название координационной теории.
ћногие положительно зар€женные ионы обладают способностью присоедин€ть к себе ионы противоположного знака или пол€рные молекулы (NH3, Ќ2ќ и др.), образу€ так называемые комплексные ионы.
—оединени€, в состав которых вход€т комплексные ионы, называютс€ комплексными, или координационными соедине≠ни€ми.
¬ насто€щее врем€ комплексных соединений известно больше, чем простых. ќтсутствие четкой границы между простыми и комплексными соединени€ми затрудн€ет опреде≠ление пон€ти€ Ђкомплексные соединени€ї. ѕоэтому существуют различные подходы к рассмотрению этого пон€ти€. ¬ одних определени€х учитываетс€ характер химической св€зи, а в других - наличие координации в твердом состо€нии.

»так, комплексными соединени€ми называютс€ вещества, содержащие центральный атом - комплексообразователь, с которым в тесной св€зи находитс€ определенное количество атомов или молекул, составл€ющих внутреннюю сферу.
омплексный ион. ѕростые соединени€ первого р€да, соедин€€сь друг с другом, образуют комплексные соединени€:
Fe(CN)3 + 3KCN → K3[Fe(CN)6],
а при диссоциации - положительно и отрицательно зар€женные комплексные ионы:
K3[Fe(CN)6]↔ 3 + + [Fe(CN)6]3-.
омплексные ионы заключены в квадратные скобки. Ёти ионы составл€ют внутреннюю сферу комплексных соединений. омплексный ион состоит из центрального атома в определенном валентном состо€нии, вокруг которого скоординировано определенное число частиц - атомов ионов или молекул. ÷ентральный атом комплексного иона называетс€ комплексообразователем, а частицы, координирующиес€ вокруг комплексообразовател€ - лигандами. омплексообразование - свойство, присущее всем элементам. ќднако дл€ одних оно характерно, дл€ других - выражено меньше.
“ипичными комплексообразовател€ми, €вл€ютс€ е/-элемен- ты больших периодов периодической системы ƒ.».ћенделеева- Ag+, Au+, Au3+, Cu+, Cu2+, Hg2+, Fe2+, Fe3+, Co2+, Co3+, Ni2+, Pt+2, Pt+4, Zn+2, Cd+2, т.е. те ионы, которые имеют незавершенную электронную оболочку и обладают сильным электрическим полем.
Ћигандами могут быть:
а) нейтральные молекулы (пол€рные): Ќ2O, NH3, NO, CO. ћолекулы-диполи тем легче станов€тс€ лигандами, чем меньше их размер и чем легче они пол€ризуютс€.
б) ионы: S2O32-, CN-, J-, CNS-, NO2-, Br-, —l-, SO42-, OH-.
омплексообразующие вещества (лиганды) должны удов≠летвор€ть следующим требовани€м:
- образовывать с ионами металла достаточно устойчивые комплексные соединени€;
- обладать поверхностно-активными свойствами и большей поверхностной энергией;
- не должны оказывать вредного вли€ни€ при комплексо- образовании.
Ётим требовани€м хорошо удовлетвор€ют алифатические амины.
«ар€д комплексного иона определ€етс€ как алгебраическа€ сумма зар€дов комплексообразовател€ и лигандов.
“ак, соединение Ag[CN]2x имеет зар€д х = 1 + (-1) Ј 2 = -1; а [PtCl6]x х = 4 + (-1) Ј 6 = -2. «на€ зар€д комплексного иона и за≠р€д лигандов, легко вычислить зар€д комплексообразовател€. Ќапример: Na3[Cox(CN)6]3- х = -3 - (-6) = 3; если K4[Fex(CN)6]4, то х = -4 - (-6) = 2; дл€ [—rх(Ќ2O)5—1]2+—12 х = 2 - (-1) =2+1= 3.
ѕримечание. Ќейтральные атомы не имеют зар€да, поэтому при подсчете зар€дов их не учитывают.
оординационное число. аждый комплексообразователь может присоедин€ть лишь определенное число лигандов. „исло координационных мест, которое занимают лиганды, называют его координационной емкостью. „исло, показывающее, сколько лигандов координируетс€ вокруг данного комплексо≠образовател€, называетс€ его координационным числом (к.ч.). «начение к.ч. определ€етс€ размерами, зар€дом, строением электронной оболочки как комплексообразовател€, так и лиганда. ’от€ к.ч. дл€ того или иного комплексообразовател€ - величина посто€нна€, тем не менее она зависит от р€да факторов: природы комплексообразовател€ и лигандов, их объемов и зар€дов, температуры и концентрации.
| омплексообразователи | оординационное число |
| Cu+, Ag+, Au+ | |
| Cu2+, Au3+, Zn2+, Cd2+, Pt4+, Hg2+ | |
| Fe2+, FeJ+, Cr3+, Co2+, Pt4+, Ni2+ | |
| Ca2+, Sr2+, Ba2+ |
Ќекоторые молекулы имеют в своем составе два атома, способных соедин€тс€ с ионом металла-комплексообразовател€. “акие молекулы (лиганды) называютс€ бидентантными, они могут образовывать клешневидные и хелатные комплексы. Ќапример, этилендиамин и др. имеют два координационных места и образуют хелатный комплекс с медью:

¬ растворах комплексные соединени€ диссоциируют на комплексный ион и противоположно зар€женные ионы внешней сферы:
K2[Zn(CN)4] ↔ 2 + + [Zn(CN)4]2-.
¬ водных растворах диссоциаци€ протекает практически полностью. ќднако кроме первой реакции диссоциации всегда происходит, хот€ и в гораздо меньшей степени, распад комплексного иона:
[Zn(CN)4]2- ↔ Zn2+ + 4CN-.
ѕри этом степень диссоциации зависит от прочности внутренней сферы комплексного соединени€. ƒл€ характеристики прочности комплекса введено пон€тие константы нестойкости ( нест.), котора€ представл€ет собой константу равновеси€ диссоциации комплексного иона:
нест = [Zn2+] [CN-]4 / [[Zn(CN)4]2Ч] = 2Ј10-17
„ем меньше константа нестойкости, тем прочнее данный комплексный ион.
—ледует отметить, что диссоциаци€ комплекса всегда протекает ступенчато, т.е. отщепл€етс€ один лиганд за другим. аждому процессу соответствует сво€ константа нестойкости.
”силить диссоциацию или даже полностью разрушить комплексный ион можно:
а) разбавлением или нагреванием раствора;
б) добавлением реагентов, дающих с одним из компонентов комплексного иона малорастворимые или еще менее диссоциируемые молекулы или ионы;
онстанта нестойкости имеет большое практическое значение. ќна позвол€ет определить:
1) возможность растворени€ различных осадков за счет образовани€ комплексных соединений;
2) устойчивость комплексных соединений по отношению к тому или иному реактиву, а следовательно, возможность распада комплекса на простые соединени€ или образовани€ из него нового, более устойчивого комплекса.
—троение комплексных соединений
—уществует р€д теорий, объ€сн€ющих строение комплекс≠ных соединений:
1. “еори€ кристаллического пол€. Ёта теори€ аналогична теории ионной св€зи в атомных соединени€х, утверждает элек≠тростатический подход к строению комплексных ионов. —о≠гласно этой теории образование комплекса есть итог электро≠статического взаимодействи€ между комплексообразователем и лигандами, а комплексообразователь и лиганды - твердые несжимаемые зар€женные шарики определенных размеров.
“еори€ кристаллического пол€ рассматривает структуру (s, р, d, f) электронов комплексообразовател€ и те изменени€, которые они претерпевают в поле лигандов как точечные зар€≠ды. ќднако теори€ кристаллического пол€ не объ€сн€ет свойств комплексов и не учитывает электронную структуру лигандов.
 2. “еори€ донорно-акцепторной св€зи. Ёта св€зь рассмат≠риваетс€ как частный случай ковалентной св€зи. “еори€ рассматривает и волновые функции s, р, d, f -электронов. ак видим, из названи€ теории вытекает сущность процессов между акцептором и донором. “ак, комплексообразователь, облада€ свободными квантовыми €чейками, может быть акцептором электронов. Ћиганды, имеющие неподеленные пары электронов, €вл€ютс€ донорами электронов. примеру, взаимодействие NH3 и BF3 следует объ€сн€ть наличием у бора свободной 2р -€чейки, а у азота - неподеленной пары 2s -электронов. ¬ этом соединении азот €вл€етс€ донором, а бор - акцептором. Ќапример:
2. “еори€ донорно-акцепторной св€зи. Ёта св€зь рассмат≠риваетс€ как частный случай ковалентной св€зи. “еори€ рассматривает и волновые функции s, р, d, f -электронов. ак видим, из названи€ теории вытекает сущность процессов между акцептором и донором. “ак, комплексообразователь, облада€ свободными квантовыми €чейками, может быть акцептором электронов. Ћиганды, имеющие неподеленные пары электронов, €вл€ютс€ донорами электронов. примеру, взаимодействие NH3 и BF3 следует объ€сн€ть наличием у бора свободной 2р -€чейки, а у азота - неподеленной пары 2s -электронов. ¬ этом соединении азот €вл€етс€ донором, а бор - акцептором. Ќапример:
Ќо у азота есть неподеленна€ пара в 2 s -состо€нии. ¬ то же врем€ у бора есть свободна€ €чейка. ”казанное условие приводит к возникновению комплексного соединени€ по схеме:
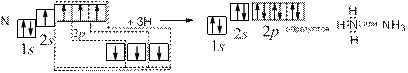 “аким образом, образование комплексных соединений по типу донорно-акцепторной св€зи можно рассматривать как разновидность ковалентной св€зи. «десь образование комплекс≠ного соединени€ не св€зано с возникновением новых электронных пар.
“аким образом, образование комплексных соединений по типу донорно-акцепторной св€зи можно рассматривать как разновидность ковалентной св€зи. «десь образование комплекс≠ного соединени€ не св€зано с возникновением новых электронных пар.
 3. “еори€ молекул€рных орбиталей. —огласно этой теории комплексы представл€ют собой единое целое, отдельные атомы и молекулы которого тер€ют и индивидуальные качества. “еори€ основана на квантово-механических представлени€х. Ёта теори€ учитывает как вли€ние электронов комплексообразовател€ на электронную структуру лигандов, так и вли€ние электронной структуры лигандов на электронную структуру комплексообразовател€. —ведени€ о свойствах комплекса устанавливают путем расщеплени€ термов в сильном и слабом пол€х лигандов и наход€т данные на основе квантово-механических расчетов.
3. “еори€ молекул€рных орбиталей. —огласно этой теории комплексы представл€ют собой единое целое, отдельные атомы и молекулы которого тер€ют и индивидуальные качества. “еори€ основана на квантово-механических представлени€х. Ёта теори€ учитывает как вли€ние электронов комплексообразовател€ на электронную структуру лигандов, так и вли€ние электронной структуры лигандов на электронную структуру комплексообразовател€. —ведени€ о свойствах комплекса устанавливают путем расщеплени€ термов в сильном и слабом пол€х лигандов и наход€т данные на основе квантово-механических расчетов.
ƒл€ примера рассмотрим распределение электронов по молекул€рным орбитал€м (ћќ) низкоспинового комплекса [Co(NH3)6]3+. »з 18 валентных электронов —о (III) и лигандов 12 электронов наход€тс€ на 6 св€зывающих ћќ (σs2σp6σdγ4) (рис. 5).
Ёто соответствует 6 σ-св€з€м комплексообразователь- лиганд. ќстальные 6 электронов в ионе [Co(nh3)6]3+ распределены только на несв€зывающих dε -орбитал€х.
–азличие в xaрактере распределени€ электронов среди d ε - и d γ -орбиталей (AO) зависит от параметра расщеплени€ (Δ). ѕри этом замечено, что чем больше степень перекрывани€ исходных атомных орбиталей (јќ), тем больше энергетическое различие между св€зывающей и разрыхл€ющей орбитал€ми. ѕоэтому чем сильнее перекрывание d γ -комплексообразовател€ с орбитал€ми лигандов, тем выше уровень σ pазp d γ ћќ и тем больше параметр расщеплени€ (Δ).
 –ис.5 –аспределение электронов по молекул€рным орбитал€м (ћќ) комплекса [Co(NH3)6]3+.
–ис.5 –аспределение электронов по молекул€рным орбитал€м (ћќ) комплекса [Co(NH3)6]3+.
„тобы иметь четкое представление о методе молекул€рных орбиталей, рассмотрим образование простой молекулы водорода Ќ2. ћолекула Ќ2 комбинируетс€ из двух одноатомных орбиталей (јќ). ѕри этом получаютс€ две ћќ: св€зывающа€ σсв 1s и разрыхл€юща€ σ разр1s. —в€зывающие ћќ (σ, π, δ, φ) и разрыхл€ющие (σразр, πразр, δразр, φразр) соответствуют атомным (s, р, d, f) орбитал€м.
–еакци€ образовани€ молекулы Ќ2 из јќ в системе ћќ имеет вид 2Ќ [1s 1] = H2[(σ cвl s)2].
¬ случае попадани€ электрона на разрыхл€ющую ћќ электронна€ плотность будет концентрироватьс€ за €драми, а между ними она равна нулю, т. е. образование молекулы не происходит (рис. 5).
Ўесть электронов в молекуле Li2 располагаютс€ на трех орбитал€х, электронна€ конфигураци€ имеет вид:
2Li [1s22s1] = Li2 [(σ cв ls)2] (σ x l s)2] (σ cв2 s)2].
–еакци€ образовани€ молекулы F2 в системе обозначени€ ћќ может быть записана так:
2F[1s22s22р5] = F2[(σ cв 1s)2][(σ разр1s)2 (σ cв 2s)2 (σ разр 2 s)2 (σ cв 2 рх)2× × (π cв 2рy, z)4 (π разр 2рy, z)4].
ƒл€ атома азота:
2N [1s22s22р3] = N2 [(σ cв 1s)2][(σ разр 1s)2(σ cв 2s)2 (σ разр 2s)2 × ×(π cв 2рy, z)4(σ cв2 рх)2].
ƒл€ молекулы —ќ:
— [1s22s22р2] + ќ [ls22s22p4]→ —ќ [ (σ cв 2s)2 (σ разр 2s)2×
× (π cв2рy, z)4 (σ cв 2p)2 (πy, πz, 2р)4].
ратность св€зи = (число электронов на ћќсв/2) - (число электронов на ћќразр/2)
ƒл€ N2 = 10 / 2 - 4 / 2 = 5 - 2 = 3;






