Природа реагирующих веществ – это не только их состав, но и вид частиц, которые непосредственно участвуют в реакции: атомы, молекулы, ионы или радикалы. Реакции между молекулами протекают обычно медленно, а между ионами и радикалами – быстро.
Влияние концентрации реагентов.
Зависимость скорости реакций от концентрации реагирующих веществ описывается основным закоом химической кинетики, устанавливающий: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Для реакции, протекающей по уравнению А + В = С + Д, этот закон выразится уравнением:
V = k · CA ∙ CB, (1)
где СА и СВ – молярные концентрации вещества А и В; k – константа скорости реакции. Физический смысл константы скорости - она численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1моль/л или когда их произведение равно единице.
Основной закон химической кинетики часто называют законом действующих масс.
Константа скорости реакции зависит от природы реагирующих веществ, температуры, присутствия катализатора, но не зависит от концентрации вещества.
Уравнение (1), связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Для реакции, записанной в общем виде  , кинетическим уравнением будет
, кинетическим уравнением будет
V = k · CmA ∙ CnB, (2)
где m и n – показатели степени, которые устанавливаются опытным путем и в большинстве случаев не равны стехиометрическим коэффициентам а и b в уравнении реакции.
Уравнение (2) является общим алгебраическим выражением закона действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам соответствующих веществ в уравнении реакции.
Сумма m + n называется порядком реакции и, как правило, имеет значение от 0 до 3 (не исключены и дробные значения и даже отрицательные).
Порядок реакции – формально-кинетическая характеристика процесса, не отражает механизма реакции, лишь характеризует зависимость скорости от концентрации.
Основной закон химической кинетики не учитывает концентрации реагирующих веществ в твердом состоянии, ибо их концентрации постоянны и они реагируют лишь на поверхности, которая остается неизменной.
Молекулярность реакции – это молекулярно-кинетическая характеристика процесса, отражающая его механизм. Определяется числом частиц, одновременно взаимодействующих в элементарном акте.
В зависимости от количества молекул, принимающих участие в элементарном акте реакции, различают моно-, би- и тримолекулярные реакции.
Лишь для одностадийных (элементарных) реакций порядок совпадает с молекулярностью. Для простых реакций стехиометрическое уравнение отражает истинный механизм.
Влияние температуры.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа, согласно которому при повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2-4 раза.
Математически эта зависимость выражается соотношением

где Vt2, Vt1 - скорость реакции соответственно при начальной (t1) и конечной (t2) температурах, а γ - температурный коэффициент скорости реакции, принимающий значение от 2 до 4. Более точно зависимость скорости реакции от температуры выражается уравнением Аррениуса:

где k - константа скорости реакции, моль/л•с; А - константа, не зависящая от температуры; Т - температура, К; R - универсальная газовая постоянная, равная 8,314 Дж/моль К; Еа - энергия активизации кДж/моль.
Энергия активации – это минимальная энергия взаимодействующих частиц, достаточная для того, чтобы все частицы вступили в химическую реакцию.
Энергия активации зависит от природы реагирующих веществ и пути протекания реакции и не зависит от температуры, если с ее изменением не произошло изменение механизма реакции.
Энергию активации определяют опытным путем и установлено, что реакции с Еа < 50 кДж/моль при 298К идут с высокой скоростью, а если Еа > 100 кДж/моль, то скорость неизмеримо мала.
Влияние катализатора
Катализом называется изменение скорости химических реакций в присутствии веществ – катализаторов.
Катализатор – это вещество, изменяющее скорость реакции за счет участия в промежуточном химическом взаимодействии с компонентами реакции, но восстанавливающее после каждого цикла промежуточного взаимодействия свой химический состав.
Различают положительный и отрицательный катализ. В случае положительного катализа скорость химической реакции при введении катализатора возрастает. При отрицательном катализе, – наоборот, уменьшается. Отрицательный катализ часто называют ингибированием, а отрицательные катализаторы, снижающие скорость реакции, ингибиторами (механизм действия последних отличен от катализаторов).
Химические реакции, протекающие в присутствии катализаторов, называются каталитическими. Различают два вида катализа – гомогенный (однородный) и гетерогенный (неоднородный) катализ.
При гомогенном катализе реагирующие вещества и катализатор образуют однородную систему – газовую или жидкую. В этом случае между катализатором и реагирующими веществами отсутствует поверхность раздела. Примером может служить действие разнообразных ферментов в биологических процессах. Для гомогенного катализа установлено, что скорость химической реакции пропорциональна концентрации катализатора.
При гетерогенном катализе реагирующие вещества и катализаторы образуют систему из разных фаз. В этом случае между катализатором и реагирующими веществами существует поверхность раздела. Обычно катализатор является твердым веществом, а реагирующие вещества – газами или жидкостями. Например, окисление аммиака (газообразная фаза) в присутствии платины (твердая фаза). Все реакции при гетерогенном катализе протекают на поверхности катализатора. Поэтому активность твердого катализатора будет зависеть и от свойств его поверхности (размера, химического состава, строения и состояния).
Действие положительных катализаторов сводится к уменьшению энергии активации реакции.
Некоторые вещества снижают или полностью уничтожают активность твердого катализатора. Такие вещества называются каталитическими ядами.
В качестве примера можно привести соединения мышьяка, ртути, свинца, цианиды, к которым особенно чувствительны платиновые катализаторы.
Однако имеются и такие вещества, которые усиливают действие катализаторов данной реакции, хотя сами катализаторами не являются. Эти вещества называются промоторами (например, промотирование платиновых катализаторов добавками железами, алюминия и др.).
Роль катализаторов в химическом производстве исключительно велика, но не менее важны биологические катализаторы – ферменты - особые веществам животного или растительного происхождения, являющихся белками. Они обладают каталитическим действием по отношению к некоторым биохимическим реакциям за счет понижения их очередной инактивации.
Химическое равновесие. Принцип Ле – Шателье
Реакции, которые протекают в одном направлении и идут до конца, называются необратимыми. Их не так много. Большинство реакций являются обратимыми, т.е. они протекают в противоположных направлениях и не идут до конца. Например, реакция J2 + H2 D 2HJ при 350°С является типичной обратимой реакцией. В этом случае устанавливается подвижное химическое равновесие и скорости прямого процесса и обратного делаются равными.
Химическое равновесие – такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
Химическое равновесие называют динамическим равновесием. При равновесии протекают и прямая, и обратная реакции, их скорости одинаковы, вследствие чего изменений в системе не заметно.
Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными концентрациями. Обычно их обозначают при помощи квадратных скобок, например, [J2], [H2], [HJ].
Количественной характеристикой химического равновесия служит величина, называемая константной химического равновесия. Для реакции в общем виде: mA + nB = pC + qD
Константа химического равновесия имеет вид:

Она зависит от температуры и природы реагирующих веществ, но не зависит от их концентрации. Константа равновесия показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции, если концентрации каждого из реагирующих веществ равна 1 моль/л. В этом физический смысл К.
Направление смещения химического равновесия при изменениях концентрации реагирующих веществ, температуры и давления (в случае газовых реакций) определяется общим положением, известным под названием принципа подвижного равновесия или принципа Ле Шателье: если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие (изменяется концентрация, температура, давление), то оно благоприятствует протеканию одной из двух противоположных реакций, которая ослабляет воздействие.
Следует отметить, что все катализаторы одинаково ускоряют как прямую, так и обратную реакции и поэтому на смещение равновесия влияние не оказывают, а только способствуют более быстрому его достижению.
Примеры решения задач
Пример 1.
Рассчитайте температурный коэффициент скорости реакции, зная, что с повышением температуры на 70 °С скорость возрастает в 128 раз.
Решение:
Для расчета используем правило Вант-Гоффа:

Ответ: 2
Пример 2.
При какой температуре закончится некоторая реакция за 0,5 мин, если при 70°С она заканчивается за 40 мин? Температурный коэффициент реакции равен 2,3.
Решение:
Для расчета используем правило Вант-Гоффа. Находим t2:
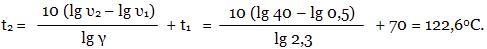
Ответ: 122,6 0С
Пример 3.
Во сколько раз изменится скорость прямой реакции N2(г)+3Н2(г)=NH3(г), если давление в системе увеличить в 2 раза?
Решение:
Увеличение давления в системе в 2 раза равносильно уменьшению объема системы в 2 раза. При этом концентрации реагирующих веществ возрастут в 2 раза. Согласно закону действия масс, начальная скорость реакции равна Vн = k·[N2]·[H2]3.
После увеличения давления в 2 раза концентрации азота и водорода увеличатся в 2 раза, и скорость реакции станет равна Vк = k·2[N2]·23[H2]3 = k·32[N2]·[H2]3. Отношение Vк/Vн показывает, как изменится скорость реакции после изменения давления. Следовательно, Vк/Vн = k·32[N2]·[H2]3/(k·[N2]·[H2]3) = 32.
Ответ: скорость реакции увеличится в 32 раза.
Пример 4.
Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению РС15(г) ↔ РС13(г) + С12(г); ∆Н = +92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — разложения РС15?
Решение:
Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения РС15 эндотермическая (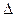 H > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру: б) так как в данной системе разложение РС15 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РС15, так и уменьшением концентрации РС13 или Сl2.
H > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру: б) так как в данной системе разложение РС15 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РС15, так и уменьшением концентрации РС13 или Сl2.






