„иста€ дистиллированна€ вода Ц это хороший диэлектрик. –аствор кислоты в воде Ц хороший проводник. ƒиполи воды, возникающие в результате действи€ электрического пол€, окружают молекулу кислоты и Ђрастаскиваютї ее на ионы (рис.21).
–аспад молекул на ионы под действием растворител€ называют электролитической диссоциацией. 
|
–исунок 21. Ёлектролитическа€ диссоциаци€
–ассмотрим процесс прохождени€ электрического тока в электролите. ¬ электролитическую ванну налит раствор серной кислоты и опущены две платиновых пластины. ѕластины называютс€ электродами. Ёлектрод, соединенный с (+) источника тока, называетс€ анодом. Ё лектрод, соединенный с (-) источника тока, называетс€ катодом.
¬ результате электролитической диссоциации в растворе образуютс€ ионы:


ѕроцессы на катодеѕроцессы на аноде


«десь  зар€д электрона. Ќа катоде выдел€етс€ газообразный водород, а на аноде Ц газообразный кислород. »з раствора уход€т части молекул воды, а составные части кислоты остаютс€ в растворе. ѕрохождение электрического тока через электролиты, сопровождающеес€ химическими превращени€ми вещества и выделением его на электродах, называетс€ электролизом. ¬ рассмотренном примере выделение вещества происходит при неактивном аноде, то есть анод выполнен из платины и не раствор€етс€ в электролите.
зар€д электрона. Ќа катоде выдел€етс€ газообразный водород, а на аноде Ц газообразный кислород. »з раствора уход€т части молекул воды, а составные части кислоты остаютс€ в растворе. ѕрохождение электрического тока через электролиты, сопровождающеес€ химическими превращени€ми вещества и выделением его на электродах, называетс€ электролизом. ¬ рассмотренном примере выделение вещества происходит при неактивном аноде, то есть анод выполнен из платины и не раствор€етс€ в электролите.
≈сли в электролитическую ванну налить раствор соли того же вещества, из которого сделан анод, то в процессе электролиза вещество выделитс€ на катоде, а анод растворитс€. ¬ этом случае анод называют активным, так как он реагирует с электролитом. “аким способом выдел€ют химически чистые металлы, например медь, серебро (рисунок 22) и т.д.
 Ёлектролиз примен€етс€ также дл€ нанесени€ сло€ одного металла на поверхность другого металла и дл€ электрополировки поверхности металлов.
Ёлектролиз примен€етс€ также дл€ нанесени€ сло€ одного металла на поверхность другого металла и дл€ электрополировки поверхности металлов.
“ок в электролите подчин€етс€ закону ќма.
|
«аконы электролиза (законы ‘араде€)
1-й закон ‘араде€: ћасса вещества  , выдел€ющегос€ при электролизе, пр€мо пропорциональна количеству электричества
, выдел€ющегос€ при электролизе, пр€мо пропорциональна количеству электричества 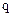 , прошедшего через раствор.
, прошедшего через раствор. 
оэффициент пропорциональности  называют электрохимическим эквивалентом вещества. ѕоскольку
называют электрохимическим эквивалентом вещества. ѕоскольку  то
то  .
.







