Недки являются амфотерными электролитами, так как и их молекулах присутствуют как кислотные, так и основные группировки. Влияние сс-амино- и а-карбоксильных фуип на кислотно-основные свойства белков незначитель-мп, тик как в молекулах белков они участвуют в образовании пептидных связей'. Амфотерность белкам придают боко-И1.К1 остатки кислых и основных аминокислот (табл. 4). Присутствие диссоциирующих —NН2 - и — СООН-групп обусловливает определенный суммарный заряд белковой молекулы, зависящей от рН среды.
Природные белки в зависимости от состава аминокислот могут иметь кислый или основной характер. В кислых белках преобладают моноаминодикарбоновьге кислоты (Асп и Глу). Молекула такого белка в растворе заряжена отрицательно:
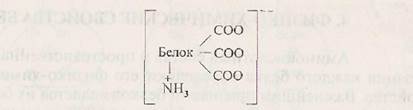
Большинство белков относится к кислым, например альбумины, глобулины, казеин, пепсин и др.
В молекулах белков основного характера преобладают ди-аминомонокарбоновые кислоты (Лиз, Арг, Гис). В растворе основные белки несут положительный заряд:
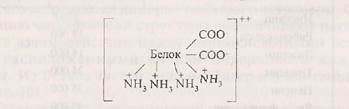
Среди этих белков — папаин, трипсин, лизоцим и др.
Суммарный заряд белковой молекулы, естественно, зависит от рН среды: в кислой среде он положителен, в щелочной — отрицателен. Распределение заряда на поверхности молекулы неравномерно, различные участки ее могут иметь противоположные заряды, стабилизированные диполями воды. Сдвиг рН среды приводит к изменению характера диссоциации группировок аминокислот, перераспределению зарядов на поверхности молекулы, что является причиной изменения пространственной структуры белка, следовательно, его биологической активности.
Наличие большого числа точек диссоциации определяет способность белка взаимодействовать с ионами металлов и другими заряженными макромолекулами, что очень важно для функционирования белков. Изменяя рН среды, можно влиять на константу диссоциации белковой молекулы как кислоты и как основания.
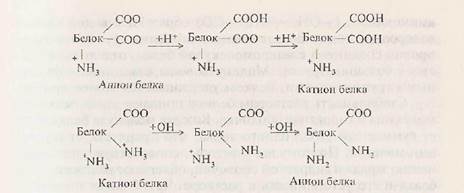 |
При определенном для каждого белка значении рН можно постичь такого состояния, когда степень кислотной диссоциации станет равной степени диссоциации белка как основания, т.е., число отрицательных зарядов сравняется с числом положительных зарядов. Заряд такой белковой молекулы в целом практически равен нулю. Значение рН, при котором белок не несет суммарного заряда, называется изоэлектрической точкой.
Изоэлектрическая точка является характерной константой белка и зависит от аминокислотного состава белковой молекулы. Чем выше соотношение кислые/основные амино-кислоты в белке, тем ниже его рН. Для большинства внутриклеточных белков рН находится в области рН от 5,5 до 7,0, что свидетельствует об отрицательном заряде цитоплазмы в ценим. Избыток отрицательных зарядов внутри клетки урав-пшичмивается неорганическими катионами.
Значение изоэлектрической точки очень важно для понимания стабильности белков в растворах, так как в ней бельм нгледствие электронейтральности наименее устойчивы. Незаряженные частицы белка могут слипаться друг с другом и выпадать в осадок.
Растворимость белков
Белки — гидрофильные вещества, хорошо растворимые в воде. Под гидратацией понимают связывание диполей воды с ионными и полярными группами. Ионными группами в белках, несущими заряд, являются все —МН2- и — СООН-группы. В диссоциированном состоянии они притягивают молекулы воды за счет ион-диполъных взаимодействий. Неионные (незаряженные) полярные боковые группировки аминокислот (—ОН, — NН, —СО) образуют с водой слабые водородные связи. Вода, связанная ионными группами, очень прочно соединена с макромолекулой белка, отделить ее удается с большим трудом. Молекулы воды, связанные с неионными группировками, белком удерживаются менее прочно. Стабильность растворам белков придают заряд белковой молекулы и гидратная оболочка, Каждая молекула белка имеет суммарный заряд одного знака, что препятствует агрегации молекул. Поэтому все факторы, способствующие сохранению заряда и гидратной оболочки, облегчают растворимость белка и его устойчивость в растворе. Чем больше полярных аминокислот в белке, тем больше молекул воды связывается. Гидратная вода может составлять до 1/5 массы белка.
Растворимость белков в воде возрастает при небольших концентрациях нейтральных солей. Это объясняется следующим: ионы солей, взаимодействуя с противоположными зарядами в белке, экранируют заряженные группы белковых молекул и тем самым уменьшают белковое взаимодействие. Повышение концентрации нейтральных солей (увеличение ионной силы раствора) оказывает обратное действие. Процесс осаждения белков нейтральными солями называется высаливанием. При больших концентрациях ионов в растворе они оттягивают молекулы воды от полярных групп белка на себя. При этом гидратная оболочка белковой молекулы частично снимается, т. е нарушается один из факторов устойчивости белка в растворе. Возможно, одновременно происходит нейтрализация зарядов белка ионами солей, что приводит к изменению второго фактора устойчивости (изменению заряда белка в целом), а следовательно, осаждению белка из раствора. Характерной особенностью белков, полученных при высаливании, является сохранение ими своих природных свойств и функций после удаления соли.
Растворимость белков зависит и от растворителя: его рН, состава и температуры. Добавление к белковому раствору смешивающихся с водой органических растворителей (этанола, ацетона и др.) уменьшает растворимость белков. При высоких концентрациях растворителей наблюдается выпадение белка в осадок (в связи с уменьшением степени гидратации белка). В растворах белки обладают коллоидными свойствами: они медленно диффундируют, не способны проникать через полупроницаемые мембраны, рассеивают свет, характеризуются высокой вязкостью.
Образование коллоидных растворов белками обусловливает многие физико-химические явления, наблюдающиеся II биологических жидкостях и организмах в целом. При определенных условиях все коллоидные растворы могут терять текучесть и образовывать гели (студни). Они возникают в результате объединения молекул в виде сетки, внутреннее пространство которой заполнено большим количеством раст-иорителя, но при этом разделения на жидкую и твердую фазы не происходит, как в случае коагуляции. В клетках живых организмов белки находятся не только в виде растворов, но и гелей (в протоплазме, хрусталике глаза, соединительных тканях и др.). Гелеобразованию легче подвергаются фибриллярные белки. Так, пищевые студни готовят из продуктов, содержащим в большом количестве фибриллярные белки (кости, хрящи, мясо). Под действием ферментов микроорганизмов белковый раствор — молоко может переходить в гель с образованием кефира, простокваши.
Белковые гели имеют важное физиологическое значение к жизнедеятельности организма. Например, коллагеновые белки костей, сухожилий, кожи и т. п. обладают высокой прочностью, эластичностью и упругостью, так как находятся в гелеобразном состоянии. Отложение минеральных солей при старении снижает их упругость и эластичность, что приводит к ряду заболеваний.
Одним из свойств гелей является их способность к набуханию — увеличению объема за счет связывания большого количества воды. Такой процесс наблюдается при прорастании семян, при замачивании крупы, при изготовлении теста и т. д. Явление обратное набуханию (отделение воды от геля) называется синерезисом. Оно протекает, например, при дли-имп.пом хранении кефира.
Благодаря наличию гидрофильных и гидрофобных групп пгнки могут влиять на растворимость других веществ, высту-м.чи и роли эмульгаторов. Известно, что эмульгаторами явля-мнгн иещества, стабилизирующие эмульсии типа «вода — лито». В организме человека в эмульгированном состоянии млчодятся жиры в крови и лимфе. Белок образует на поверхности капелек жира (за счет гидрофобных взаимодействий) тонкую пленку, которая притягивает воду (за счет полярных групп) и препятствует слипанию жировых частиц. Казеин молока можно рассматривать как эмульгатор, стабилизирующий природную эмульсию — молоко.
Денатурация белков
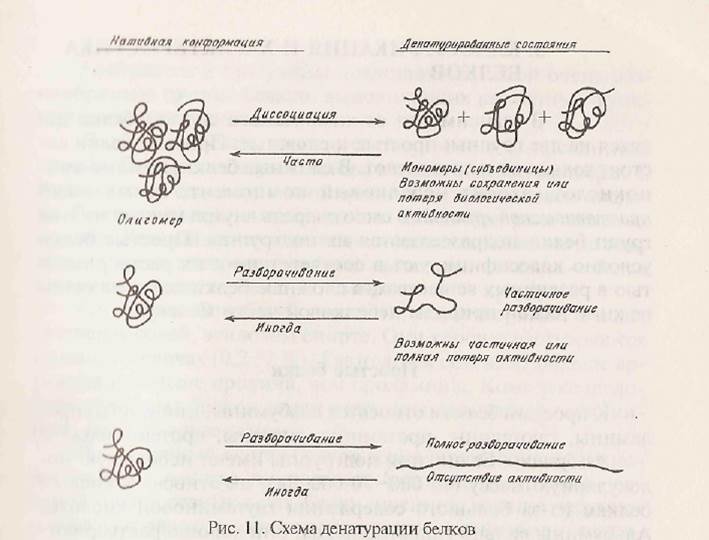
Под действием различных факторов нативная пространственная структура белковой молекулы может нарушаться: разрушаются четвертичная, третичная и вторичная структуры (изменения не затрагивают первичную структуру). Это явление называется денатурацией. Денатурация белка приводит к уменьшению или полной потере растворимости, утрате специфической биологической активности, изменению оптических свойств и вязкости и др. При денатурации разрываются связи, стабилизирующие структуру белковой молекулы: ионные, водородные и дисульфидные, нарушается гидрофобное взаимодействие. ГТолипептидная цепь раскручивается и находится в растворе в развернутом состоянии или в виде беспорядочного клубка. Степень денатурации белка может быть различной в зависимости от его физико-химических свойств, природы денатурирующего агента и времени его действия. Схематично процессы денатурации изображены на рисунке 11. Отметим, что для некоторых белков денатурация обратима (белки мышц). При этом и нативная конформация и биологическая активность белка могут быть восстановлены. Денатурирующие факторы можно разделить на физические и химические. К физическим агентам относится температура, давление, механическое воздействие, ультразвуковое и ионизирующее излучение. Наиболее общим фактором является нагревание. Тепловая денатурация белков — один из характерных их признаков. Усиление теплового движения атомов полипептидной цепи приводит к разрыву слабых нековалентных связей. Скорость тепловой денатурации существенно зависит от рН среды, ионной силы раствора. Тепловая денатурация сопровождается агрегацией белков, выпадением их в осадок. Наиболее полное и быстрое осаждение происходит в изоэлектрической точке.
Белки денатурируют при растирании сухих препаратов, энергичном встряхивании растворов, взбивании и т. д. При лиофилизации белков (высушивание в вакууме путем возгонки влаги из замороженного состояния) большинство их не денатурирует, что позволяет использовать этот способ сушки для длительного хранения белковых препаратов.
К химическим факторам, вызывающим денатурацию, относятся кислоты, щелочи, органические растворители, поверхностно-активные вещества, алкалоиды, тяжелые металлы и т. п.
Денатурация белков играет существенную роль в жизненных процессах. По мере старения организма происходит постепенная дена!урация белков и снижение их гидрофильности. Так, при старении семян денатурация белков приводит к потере их способности к прорастанию. Происходящее при денатурации превращение компактной молекулы в беспорядочный клубок облегчает доступ протеолитических ферментов к пептидным связям, которые они разрывают. Поэтому денатурированные белки легче расщепляются ферментами, чем нативные. Следовательно, денатурированные белки в желудочно-кишечном тракте человека будут лучше перевариваться. Этому способствует термическая обработка продуктов, содержащих белки (мясо, рыба). В желудке человека вырабатывается соляная кислота, которая, вызывая денатурацию белков, помогает расщеплению их ферментами и усвоению организмом.
Целый ряд технологических процессов получения пищевых продуктов (выпечка хлеба и кондитерских изделий, сушка макарон, овощей, молока, яичного порошка, изготовление консервов и т. д.) связан с частичной денатурацией белков, входящих в состав сырья.






