I. ќбща€ характеристика алкенов.
јлкены __ это непредельные углеводороды, молекулы которых имеют одну двой-ную св€зь.
ќбща€ формула: CnH2n.
јтомы углерода наход€тс€ в состо€нии sp2 Ц гибридизации, валентный угол равен 120˚.
ƒлина двойной св€зи 0,133 нм. ƒвойна€ св€зь состоит из π и δ св€зей.
Ёнерги€ = 606 кƒж/моль (энерги€ π-св€зи 259 кƒж/моль, δ-св€зи 347 кƒж/ моль).
—уффикс, характерный дл€ алкенов, ен.
√омологический р€д
CnH2n радикалы
1. C2H4 этен (этилен) H2C ═ CH Ц
2. C3H6 пропен (пропилен) винил (этенил)
3. C4H8 бутен (бутилен) —H2 ═ CHЧ CH2 Ц
4. C5H10 пентен аллил (пропенил)
5. C6H12 гексен
6. C7H14 гептен
7. C8H16 октен
8. C9H18 нонен
9. C10H20 декен
II. Ќоменклатура алкенов.
ѕо международной систематической номенклатуре названи€ алкенам дают следующим образом:
1. ¬ыбирают наиболее длинную углеродную цепь (в нее должна об€зательно входить двойна€ св€зь).
2. Ќумеруют атомы углерода в основной цепи с того конца. к которому ближе двойна€ св€зь.
3. ÷ифры впереди показывают местоположение боковых цепей. затем называют сами боковые цепи в алфавитном пор€дке.
4. Ќазывают основную цепь с суффиксом -ен на конце.
5. ÷ифра в конце названи€ показывает местоположение двойной св€зи.
CH3 C2H5
6 5 4│ 3│ 2 1
CH3 Ч CH Ч CH Ч C = C Ч CH2 Ч CH3
7,8│ │
C2H5 CH3
4.5.6 Ц триметил Ц 3 Ц этилоктен Ц 3
III. »зомери€.
ƒл€ алкенов характерны следующие виды изомерии:
ѕространственна€ ( стериоизомери€, цис-. транс- изомери€)
H3C Ч CH ═ CH Ч CH3
бутен-2
H3C CH3 H3C H
\ / \ /
C ═ C C ═ C
/ \ / \
H H H CH3
цис Ц изомер бутена Ц 2 транс Ц изомер бутена Ц 2
÷ис-изомер Ч изомер, в котором два одинаковых заместител€ у двух атомов углерода, св€занных двойной св€зью, расположены по одну сторону плоскости
π-св€зи.
“ранс-изомер Ч изомер, в котором два одинаковых заместител€ расположены по разные стороны плоскости π-св€зи. “ранс-изомеры всегда более устойчивы, чем цис--изомеры.
1. »зомеры углеродной цепи (структурна€ изомери€).
H2 C ═ CH ― CH2 ― CH2 ― CH3 H2C ═ C ― CH2 ― CH3
пентен Ц 1 │
CH3
2- метилбутен Ц 1
2. »зомеры положени€ двойной св€зи:
CH2 ═ CH ― CH2 ― CH2 ― CH3 H3C ― CH ═ CH ― CH2 ― CH3
пентен Ц 1 пентен Ц 2
3. ћежклассова€ изомери€:
јлканы изомерны циклоалканам.
—3H6
ЧЧЧЧЧЧЧЧЧ
↓ ↓
CH2
 /
/
CH3 ―CH═CH2 H2— ― CH2
пропен циклопропан
IV ‘изические свойства:
с —2 по —4 ― газы
с —5 по —16 ― жидкости
с —17 ― твердые вещества
Ётилен ― бесцветный газ со слабым сладковатым запахом, легче воздуха. ќбладает
|
|
|
наркотическими свойствами.
V. ѕолучение алкенов.
јлкены можно получить:
1.ѕиролизом алканов (расщепление при высокой температуре)
t=700˚C ЧЧЧЧ→ CH2 ═ CH2 этилен
H3C ― CH2 ― CH2 ― CH2 ― CH3 ――――――――|
ЧЧЧЧ→—H3 ─ CH2 ― CH3 пропан
2.–еакци€ми элиминировани€:
Ёлиминирование (отщепление двух атомов или групп атомов от соседних атомов углерода с образованием между ними π Ц св€зи).
а) дегидрогалогенирование:
H3C ― CH ― CH2 + KOH ЧЧЧ→ H3C Ч CH = CH2 + KBr + H2O
| | спирт. р-р.
Br H
2 Ц бромпропан пропен Ц 1
б) дегидратаци€:
H2SO4 (k), t = 170˚C
H2C ― CH2 ЧЧЧЧЧЧЧЧЧЧЧЧЧЧЧ→ H2O + H2C = CH2
│ │ этен
H OH
этиловый спирт
в) дегалогенирование:
CH3 CH3
│ t │
H3C Ч C Ч CH Ч CH3 + Zn ЧЧЧЧ→ H2C Ч C ═ CH Ч CH3 + ZnBr2
│ │
Br Br 2 Ц метилбутен Ц 2
2,3 Ц дибром Ц 2 - метилбутан
г) дегидрирование алканов:
t
CnH2n+2 ЧЧ→ CnH2n + H2↑
к, t= 500˚C ЧЧЧ→ H3C Ч CH = CH ─ CH3 + H2↑
2H3C ─ CH2 ─ CH2 ─ CH3 ЧЧЧЧЧЧЧ│ бутен Ц 2
бутан ЧЧЧ→ H2C = CHЧ CH2 Ч CH3 + H2↑
бутен Ц 1
3 ѕри разложении нефтепродуктов.
4.√идрированием алкинов:
t; к Ni, Pt
CnH2n-2 + H2 ЧЧЧЧЧ→ CnH2n
VI. ’имические свойства.
—пособность к реакци€м присоединени€ характерна дл€ всех алкенов, которые идут по механизму электрофильного присоединени€, т.е. присоединени€ положительно-
-зар€женной частицы к электронному облаку π Ц св€зи.
1. ѕрисоединение водорода (гидрирование,гидрогенизаци€).
 |
↓ t = 100˚C, к = Ni (Pt, Pd)
CH2 = CH2 + H2 ЧЧЧЧЧЧЧЧЧЧЧЧЧЧЧ→ CH3 Ч CH3
 ↑
↑
 этен (этилен) этан
этен (этилен) этан
2. ѕрисоединение галогенов (реакци€ галогенировани€).

 ↓ t=20˚C, к=FeCl3 1 2
↓ t=20˚C, к=FeCl3 1 2
 —H2 = CH2 + Cl2 ЧЧЧЧЧЧЧЧЧЧЧЧ→ Cl Ч H2C Ч CH2 Ч Cl
—H2 = CH2 + Cl2 ЧЧЧЧЧЧЧЧЧЧЧЧ→ Cl Ч H2C Ч CH2 Ч Cl
 ↑
↑
 этен 1,2-дихлорэтан
этен 1,2-дихлорэтан
ƒихлорэтан Ч жидкость, котора€ хорошо раствор€ет органические вещества.
ћеханизм реакции электрофильного присоединени€.
–еакции присоединени€ идут в четыре стадии:
а) ѕол€ризуемость молекулы:
δ+ δ- δ+ δ-
—l: Cl ЧЧЧЧЧ→ Cl -: Cl + FeCl3 ЧЧЧЧЧ→ Cl Ч FeCl4
б) ќбразование π Ц комплекса:
δ+ δ-
H2C = CH2 + Cl Ч FeCl4 ЧЧЧЧЧ→ CH2 ═ CH2
π ↑ δ+ δ-
Cl Ч Fe Cl4
в) ќбразование карбокатиона (карбокатионЧ это частица с положительным зар€дом на атоме углерода.)
+ - 0
—H2 ═ CH2 ЧЧЧЧЧЧЧ→ CH2 Ч CH2 + Cl +FeCl3
↑ δ+ δ- │
Cl Ч FeCl4 Cl
г) —табилизаци€ молекул.
+ Ц 0
—H2 Ч CH2 + Cl ЧЧЧЧ→ CH2 Ч CH2
│ │ │
Cl Cl Cl
3.ѕрисоединение галогеноводородов (гидрогалогенирование).
 |
↓ t
 а) —H2 = CH2 + HCl ЧЧЧЧ→ CH3 Ч CH2Cl
а) —H2 = CH2 + HCl ЧЧЧЧ→ CH3 Ч CH2Cl
 этен ↑ 1- хлорэтан
этен ↑ 1- хлорэтан
t
б) —H3 Ч CH ═ CH2 + HBr ЧЧЧЧ→ CH3 Ч CH Ч CH3
│
. Br
пропен 2 Ц бромпропан
ѕравило ћорковникова: Ђѕрисоединение атома водорода происходит всегда к наиболее гидрогенизированному атому углеродаї.
|
|
|
4.ѕрисоединение воды (реакци€ гидратации).
K=H2SO4
 ↓ │ t
↓ │ t
CH2 = CH2 + H2O ЧЧЧЧЧ→ CH3 Ч CH2OH
 ↑ (HOH) этиловый спирт
↑ (HOH) этиловый спирт
│
T,k
а) CH2 = CH2 + HO Ч SO2 Ч OH ЧЧЧ→ CH3 Ч CH2 Ч O Ч SO2 Ч OH
серна€ кислота этилсерна€ кислота
t,k
б) —H3 Ч CH2 Ч O Ч SO2 Ч OH + HOH ЧЧЧ→ CH3CH2OH + HO Ч SO2 ЧOH
этилсерна€ кислота этиловый серна€
спирт кислота
5.–еакции окислени€.
t=300˚C, k=Ag
а) 2—H2 = CH2 + O2 ЧЧЧЧЧЧЧ→ 2CH2 Ч CH2
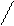

O
этоксиэтан
6.√орение.
Ётилен горит свет€щис€ пламенем с образованием —ќ2 и Ќ2ќ, слегка копт€щим пламенем.
t
а) —2Ќ4 + 3ќ2 ЧЧЧЧ→ 2—ќ2↑ + 2Ќ2ќ (в струе кислорода)
избыток
t
б) —2Ќ4 + 2ќ2 ЧЧЧЧ→ —ќ2↑ + 2Ќ2ќ + — (горение на воздухе)
недостаток
7.–азложение.
t
—2Ќ4 ЧЧЧЧЧ→ 2— + 2Ќ2↑
8.–еакци€ полимеризации.
H H
t,k │ │
а) n H2C = CH2 ЧЧЧЧЧЧ→ (Ч C Ч CЧ) n
│ │
H H
полиэтилен
t,k
б) n CH2 = CH ЧЧЧЧЧ→ (ЧCH2ЧCHЧ) n
│ │
CN CN
акрилонитрил полиакрилонитрил
9.–еакци€ √арриуса.
t менее 20˚—
Ќ3—Ч—Ќ = —Ќ2 + ќ3 ЧЧЧЧЧЧЧ→ Ќ3— Ч —Ќ Ч ќ Ч —Ќ2 + Ќ2ќ →
│ │
ќЧЧЧЧ ќ озонид
ќ ќ
// // / ЧЧ→ —Ќ3 Ч — + Ќ Ч — + Ќ2ќ2
\ \
Ќ Ќ
этаналь метаналь пероксид водорода
ќзониды Ч сильно взрывчатые вещества.
ачественные реакции на непредельные углеводороды (реакции на двойную св€зь).
1. –еакци€ окислени€ (реакци€ ¬агнера,обесцвечивание раствора Mnќ4)
а) в нейтральной среде:
3—Ќ2 = —Ќ2 + 2 мnO4 + 4H2OЧЧ→3CH2OH Ч CH2OH + 2MnO2↓ + 2KOH
этилен фиолетовый этиленгликоль буров. цв.
раствор
б) в щелочной среде:
—2Ќ4 + 2KOH + 2KћnO4 ЧЧЧ→ C2H6O2 + 2K2MnO4
перманганат этиленгликоль манганат кали€
кали€ (р-р. зелЄного цвета)
2. ќбесцвечивание избытка брома в бромной воде
Ќ2— = —Ќ2 + Br2 ЧЧЧ→ CH2 Ч CH2
│ │
Br Br
1,2 дибромэтан
VII.ѕ–»ћ≈Ќ≈Ќ»≈ јЋ ≈Ќќ¬.
1. —2Ќ4-этилен Ц газ, малорастворимый в воде. Ўироко используетс€ в орг. синтезе. ќбладает слабым наркотическим действием. ¬ обогащенной этиленом атмосфере происходит ускоренное созревание плодов и овощей.
2. ѕропен используют дл€ получени€ спиртов, ацетона, полипропилена.
3. ќзониды используют дл€ получени€ альдегидов и карбоновых кислот, взрывчатых веществ.
4. ¬ медицине используют смесь этилена и ацетилена Ц Ђнарциленї дл€ ингал€ционного наркоза.
«јƒјЌ»≈ Ќј —јћќѕќƒ√ќ“ќ¬ ”.
1. «аписать все возможные изомеры бутена, пентена, гексена. ƒать им название по международной номенклатуре.
2. ”кажите, какие вещества, формулы которых представлены ниже, €вл€ютс€:
а) гомологами; б) изомерами:
а) CH2═CH―CH2―CH3; б) —Ќ3―—Ќ═—Ќ―—Ќ3;
в)—Ќ3―—Ќ═—Ќ―—Ќ2―—Ќ3; г) —Ќ3 —Ќ2―—Ќ3; д) —Ќ3―—═—Ќ―—Ќ3
│ │ │
—Ќ ═ —Ќ —Ќ3
е) —Ќ3 ― —Ќ═—Ќ2; ж) —Ќ3―— ══ —―—Ќ3 .
│ │
—Ќ3 —Ќ3
3. —колько веществ представлено следующими формулами:
—Ќ3 б) —Ќ2―—Ќ―—Ќ3; в) —Ќ3 —Ќ2
/ │ │ │ ║
а) —Ќ3―—―—Ќ —Ќ2Ч —ЌЧ —Ќ3 —Ќ ― — ― —Ќ3;
║ \ │
—Ќ2 —Ќ3 —Ќ3
г) —Ќ3―—══ —Ќ2 ; д) —Ќ3―—Ќ2 е) —Ќ3―—―—Ќ3 ;
│ \ ║
—Ќ3―—Ќ―—Ќ3 —═—Ќ2; —Ќ3―—―—Ќ3
/
—Ќ3― —Ќ2
ж) —Ќ3―—═—Ќ2; з) —Ќ2═— ― —Ќ―—Ќ3; и) —Ќ2═—Ќ―—Ќ2―—Ќ2―—Ќ3
│ │ │
—Ќ3 —Ќ3 —Ќ3
|
|
|
4. Ќазовите по систематической номенклатуре соединени€:
а) —Ќ3─—─—Ќ2─—Ќ3 ; б) —2Ќ5 —Ќ3 в) —Ќ3
║ \ / │
—Ќ2 —═—; —Ќ2═—Ќ―—―—Ќ3.
/ \ │
—Ќ3 —2Ќ5 —Ќ3
5. Ќапишите структурные формулы соединений: а) 3,3-диметилпентен-1,
б) 3-метил-4-этилгексен-2, в) 2,3-диметилпентен-2.






