Химический состав живых организмов
Элементный состав
Химический состав живых организмов можно выразить в двух видах — атомном и молекулярном. Атомный (элементный) состав характеризует соотношение атомов элементов, входящих в живые организмы. Молекулярный (вещественный) состав отражает соотношение молекул веществ.
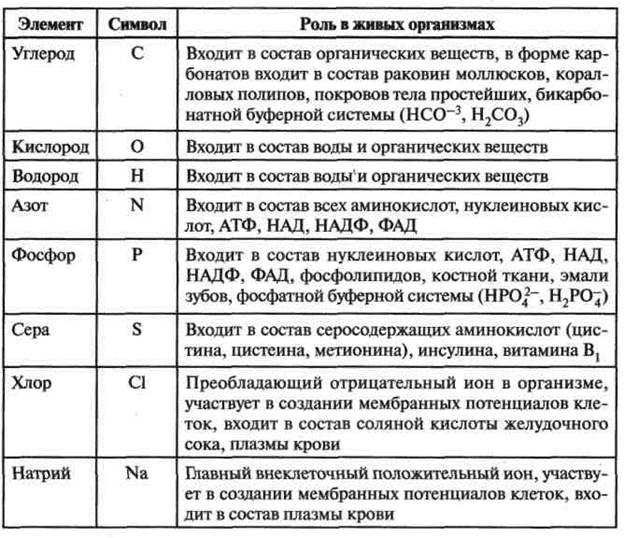
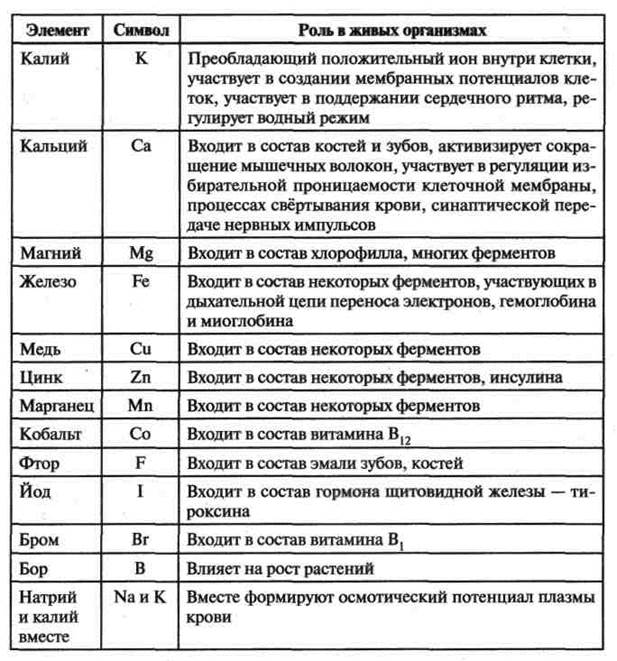
По относительному содержанию элементы, входящие в состав живых организмов, принято делить на три группы:
/. Макроэлементы — О, С, Н, N (в сумме около 98—99 %, их еще называют основные); Са, К, Si, Mg, P, S, Na, CI, Fe (в сумме
около 1—2%). Макроэлементы составляют основную массу процентного состава живых организмов.
2. Микроэлементы — Mn, Co, Zn, Си, В, I, F и др. Их суммарное содержание в клетке составляет порядка 0,1%.
3. Ультрамикроэлементы — Se, U, Hg, Ra, Au, Ag и др. Их содержание в клетке очень незначительно (менее 0,01 %), а физиологическая роль большинства из них не раскрыта.
Химические элементы, которые входят в состав живых организмов и при этом выполняют биологические функции, называются биогенными. Даже те из них, которые содержатся в клетках в ничтожно малых количествах, ничем не могут быть заменены и совершенно необходимы для жизни
Молекулярный состав
Химические элементы входят в состав клеток в виде ионов и молекул неорганических и органических веществ. Важнейшие неорганические вещества в клетке — вода и минеральные соли, важнейшие органические вещества — углеводы, липиды, белки и нуклеиновые кислоты.
Вода
Вода — преобладающий компонент всех живых организмов. Она обладает уникальными свойствами благодаря особенностям строения: молекулы воды имеют форму диполя и между ними образуются водородные связи. Среднее содержание воды в клетках большинства живых организмов составляет около 70 %. Вода в клетке присутствует в двух формах: свободной (95 % всей воды клетки) и связанной (4—5 % связаны с белками).
Функции воды:
1. Вода — растворитель.
2. Вода — реагент.
3. Транспортная функция.
4. Вода — термостабилизатор и терморегулятор.
5. Структурная функция.

Углеводы Углеводы — органические соединения, состоящие из одной или многих молекул простых Сахаров. Содержание углеводов в животных клетках составляет 1—5 %, а в некоторых клетках растений достигает 70%. Выделяют три группы углеводов: моносахариды (или простые сахара), олигосахариды (состоят из 2—10 молекул простых Сахаров), полисахариды (состоят более чем из 10 молекул сахаров).
Моносахариды: рибоза, дезоксирибоза, глюкоза, фруктоза. Олигосахариды: мальтоза, лактоза, сахароза. Полисахариды: целлюлоза, крахмал, гликоген, хитин.
Функции углеводов:
1. Энергетическая (глюкоза).
2. Запасающая (крахмал и гликоген).
3. Строительная, или структурная (целлюлоза, хитин).
4. Рецепторная (гликопротеины).
Липиды
Липиды — жиры и жироподобные органические соединения, практически нерастворимые в воде. Их содержание в разных клетках сильно варьирует: от 2—3 до 50—90 % в клетках семян растений и жировой ткани животных. В химическом отношении липиды, как правило, сложные эфиры жирных кислот и ряда спиртов. Они делятся на несколько классов. Наиболее распространены в живой природе нейтральные жиры, воски, фосфолипиды, стероиды. В состав большинства липидов входят жирные кислоты, молекулы которых содержат гидрофобный длинноцепочечный углеводородный «хвост» и гидрофильную карбоксильную группу.
Функции липидов:
1. Строительная, или структурная (фосфолипиды, холестерин).
2. Гормональная, или регуляторная (тестостерон, прогестерон, кортизон).
3. Энергетическая.
4. Запасающая.
5. Защитная.
6. Участие в метаболизме (витамин D).
Белки
Белки — это биологические гетерополимеры, мономерами которых являются аминокислоты. В образовании белков участвуют только 20 аминокислот. Они называются фундаментальными, или основными. Некоторые из аминокислот не синтезируются в организмах животных и человека и должны поступать с растительной пищей (они называются незаменимыми). Аминокислоты, соединяясь друг с другом ковалентными пептидными связями, образуют различной длины пептиды.
Выделяют 4 уровня организации белков:
Первичная структура — последовательность аминокислот в полипептидной цепи. Она образуется за счет ковалентных пептидных связей между аминокислотными остатками.
Вторичная структура образуется укладкой полипептидных цепей в α-спираль или
β-структуру. Она поддерживается за счет водородных связей между атомами водорода групп NH- и атомами кислорода групп СО—, α -спираль формируется в результате скручивания полипептидной цепи в спираль с одинаковыми расстояниями между витками. Она характерна для глобулярных белков, имеющих сферическую форму глобулы, β -структура представляет собой продольную укладку трех полипептидных цепей. Она характерна для фибриллярных белков, имеющих вытянутую форму фибриллы. Третичная и четвертичная структуры имеют только глобулярные белки.
Третичная структура образуется при сворачивании спирали в клубок (глобулу, домен). Домены — глобулоподобные образования с гидрофобной сердцевиной и гидрофильным наружным слоем. Третичная структура формируется за счет связей, образующихся между радикалами R-аминокислот, за счет ионных, гидрофобных и дисперсионных взаимодействий, а также за счет образования дисульфидных (S—S) связей между радикалами цистеина.
Четвертичная структура характерна для сложных белков, состоящих из двух и более полипептидных цепей, не связанных ковалент-ными связями, а также для белков, содержащих небелковые компоненты (ионы металлов, коферменты). Четвертичная структура поддерживается такими же химическими связями, как и третичная.
Утрата белковой молекулой своей структурной организации называется денатурацией.
По химическому составу различают простые и сложные белки. Простые белки состоят только из аминокислот. Сложные белки содержат белковую часть и небелковую — простетические группы.
Функции белков:
1. Каталитическая, или ферментативная (все ферменты).
2. Строительная, или структурная (кератины, коллаген, эластин).
3. Транспортная (гемоглобин).
4. Гормональная, или регуляторная (инсулин).
5. Защитная (иммуноглобулины).
6. Сократительная, или двигательная (актин и миозин).
7. Рецепторная (сигнальная).
8. Энергетическая.
Нуклеиновые кислоты
Существуют два типа нуклеиновых кислот: ДНК и РНК. Нуклеиновые кислоты — полимеры, мономерами которых служат нуклеотиды. Нуклеотиды ДНК и РНК состоят из следующих компонентов:
1. Азотистое основание (в ДНК: аденин, гуанин, цитозин и тимин; в РНК: аденин, гуанин, цитозин и урацил).
2. Сахар-пентоза (в ДНК — дезоксирибоза, в РНК — рибоза).
Остаток фосфорной кислоты.
ДНК (дезоксирибонуклеиновые кислоты) — длинноцепочечный не-разветвленный полимер, состоящий из четырех типов мономеров — нуклеотидов А, Т, Г и Ц — связанных друг с другом ковалентной связью через остатки фосфорной кислоты.
Молекула ДНК состоит из двух спирально закрученных цепей (двойная спираль). При этом аденин образует 2 водородные связи с тимином, а гуанин — 3 связи с цитозином. Эти пары азотистых оснований называют комплементарными.
Связываясь с белками, молекула ДНК образует хромосому. Хромосома — комплекс одной молекулы ДНК с белками. Молекулы ДНК эукариотических организмов (грибов, растений и животных) линейны, незамкнуты, связаны с белками, образуя хромосомы. У прокариот (бактерий) ДНК замкнута в кольцо, не связана с белками, не образует линейную хромосому.
Функция ДНК: хранение, передача и воспроизведение в ряду поколений генетической информации. ДНК определяет, какие белки и в каких количествах необходимо синтезировать.
РНК (рибонуклеиновые кислоты) вместо дезоксирибозы содержат рибозу, а вместо тимина — урацил. РНК, как правило, имеют лишь одну цепь, более короткую, чем цепи ДНК. Двуцепочечные РНК встречаются у некоторых вирусов.
Виды РНК:
Информационная (матричная) РНК — иРНК (или мРНК).
Транспортная РНК — тРНК.
Рибосомная РНК — рРНК.
Функции РНК: участие в биосинтезе белков.
Молекулы ДНК обладают способностью, неприсущей ни одной другой молекуле, — способностью к удвоению. Процесс удвоения молекул ДНК называется репликацией. В основе репликации лежит принцип комплементарности — образование водородных связей между нуклеотидами А и Т, Г и Ц.






