Запишите сведения по элементам №3-№9 в таблицу.
| Химический символ | Порядковый номер элемента | Относительная атомная масса элемента | Электронная формула элемента |
| Li | |||
| Be | |||
| В | |||
| С | |||
| N | |||
| O | |||
| F |
Сформулируйте выявленную вами закономерность в виде закона.
Лабораторная работа №2
Тема: Приготовление суспензии карбоната кальция в воде. Получение эмульсии моторного масла. Ознакомление со свойствами дисперсных систем.
Цели работы: изучить способы приготовления эмульсий и суспензий;научиться отличать коллоидный раствор от истинного; отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии.
Приборы и реактивы; ступка с пестиком, ложка-шпатель, стакан, стеклянная палочка, фонарик, пробирка;вода, карбонат кальция (кусочек мела), масло, ПАВ, мука, раствор крахмала, раствор сахара.
Ход работы:
1 Инструктаж по ТБ
Меры безопасности:
Осторожно использовать стеклянную посуду .
Правила первой помощи:
При ранении стеклом удалите осколки из раны, смажьте края раны раствором йода и перевяжите бинтом. При необходимости обратиться к врачу.
Опыт № 1. Приготовление суспензии карбоната кальция в воде
В стеклянную пробирку влить 4-5мл воды и всыпать 1-2 ложечки карбоната кальция. Пробирку закрыть резиновой пробкой и встряхнуть пробирку несколько раз.
Наблюдали:
Внешний вид и видимость частиц:
.....................................................................................................................................................
Способность осаждаться и способность к коагуляции.........................................................................................................................................................................
Полученная смесь похожа ………………………………………………………………………………
Опыт № 2. Получение эмульсии моторного масла
В стеклянную пробирку влить 4-5мл воды и 1-2 мл масла, закрыть резиновой пробкой и встряхнуть пробирку несколько раз.
Наблюдали:
Внешний вид и видимость частиц:
.....................................................................................................................................................
Способность осаждаться и способность к коагуляции.........................................................................................................................................................................
Добавьте каплю ПАВ (эмульгатора) и перемешайте ещё раз.
Наблюдали:
Внешний вид и видимость частиц:
.....................................................................................................................................................
Способность осаждаться и способность к коагуляции.........................................................................................................................................................................
Вывод: …………………………………………………………………………………………………………………
Опыт № 3. Приготовление коллоидного раствора и изучение его свойств
В стеклянный стакан с горячей водой внести 1-2 ложечки муки(или желатина), тщательно перемешать Наблюдали:
Внешний вид и видимость частиц:
.....................................................................................................................................................
Способность осаждаться и способность к коагуляции.........................................................................................................................................................................
Пропустить через раствор луч света фонарика на фоне темной бумаги. Наблюдается ли эффект Тиндаля?
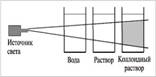
Вывод:
Лабораторная работа №3
Тема:«Приготовление раствора заданной концентрации.»
Цель: Познакомиться с понятиями раствор, концентрация, растворитель, растворенные вещества. Усовершенствование умений рассчитывать массовую долю, процентную, молярную концентрации, а также готовить растворы на основании данных расчетов.
Оборудование: Химические стаканы (или конусообразные колбы), стеклянные шпатели, мерные цилиндры, технохимические весы с разновесами, дистиллированная вода, кристаллические соли
Ход работы
1 Инструктаж по ТБ
Меры безопасности:
Осторожно использовать стеклянную посуду .
Правила первой помощи:
При ранении стеклом удалите осколки из раны, смажьте края раны раствором йода и перевяжите бинтом. При необходимости обратиться к врачу.
2 Приготовление раствора соли с определенной массовой долей растворенного вещества
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Сделайте вывод по лабораторной работе.
Лабораторная работа №4
Тема: Реакции ионногообмена в рас творах электролитов.
Цель: Провести реакции ионного обмена в растворах электролитов.
Оборудование: Штатив для пробирок, пробирки, растворы KOH,FeSO4,ZnSO4,HCl, K2CO3
Ход работы:
1 Методические указания
Реакции ионного обмена — реакции, протекающие между ионами в растворе электролитов.
Для составления уравнений реакций ионного обмена необходимо помнить следующее:
Диссоциации не подвергаются: оксиды, газообразные вещества, вода, нерастворимые в воде соединения
Реакция ионного обмена идёт до конца если образуется: газ, осадок, вода
2Инструктаж по ТБ
1 Физиологическое действие используемых реактивов:
- Кислоты и щелочи вызывают ожоги на коже.
2 Меры безопасности:
Не допускать попадания кислоты и щелочи на руки или одежду
Осторожно использовать стеклянную посуду
3 Правила первой помощи
Пораженное кислотой место промыть большим количеством воды, или 2% раствором соды.
Пораженное щелочами место промыть большим количеством воды, или 1% раствором уксусной кислоты.
При необходимости обращаться к врачу
3 Выполнение работы:
Выполните следующие опыты, запишите результаты наблюдений, составьте уравнения реакций в молекулярном и ионном виде.
Опыт №1 Налейте в одну пробирку 1 мл раствораFeSO4 , а во вторую- такое же количество ZnSO4 добавьте в каждую раствор КОН.
В первой пробирке наблюдаете ___________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Во второй пробирке наблюдаете ___________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Опыт № 2
К полученным в предыдущем опыте осадкам добавьте раствор HCl.
Наблюдаете ___________________________________________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Во второй пробирке наблюдаете _______________________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Опыт №3
В пробирку налейте 1 мл раствора K2CO3 и добавьте 1-2 мл раствора HCl.
В пробирке наблюдаете _______________________________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Сделайте вывод по лабораторной работе.
Лабораторная работа 5
Тема: Химические свойства кислот на примере H2SO4
Цель: Изучить химические свойства кислот на примере серной кислоты
Оборудование: пробирки, штатив для пробирок.
Реактивы: железо, растворы серной кислоты, гидроксида калия, хлорида бария, сульфата меди (ІІ), карбоната натрия,метилового оранжевого,фенолфталеина.
Ход работы:
2 Инструктаж по ТБ
1 Физиологическое действие используемых реактивов:
- Кислоты и щелочи вызывают ожоги на коже.
2 Меры безопасности:
Не допускать попадания кислоты и щелочи на руки или одежду. Осторожно использовать стеклянную посуду
3 Правила первой помощи
Пораженное кислотой место промыть большим количеством воды, или 2% раствором соды.
Пораженное щелочами место промыть большим количеством воды, или 1% раствором уксусной кислоты.
При необходимости обращаться к врачу
3 Выполнение работы
Опыт 1Действие кислоты на индикаторы.
К раствору серной кислоты добавьте раствор метилового оранжевого.
В пробирке наблюдаете _______________________________________________________________
Опыт 2 Взаимодействие серной кислоты с металлами.
К раствору серной кислоты добавьте железо.
В пробирке наблюдаете _______________________________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Опыт 3 Взаимодействие серной кислоты с основаниями.
А) растворимыми в воде.
К раствору гидроксида калия добавьте несколько капель фенолфталеина.
В пробирке наблюдаете _______________________________________________________________
Добавьте немного серной кислоты.
В пробирке наблюдаете _______________________________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
б) нерастворимыми в воде.
К раствору сульфата меди (ІІ)добавьте раствор гидроксида калия.
В пробирке наблюдаете _______________________________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Затем добавьте немного раствора серной кислоты.
В пробирке наблюдаете _______________________________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Опыт 4 Взаимодействие серной кислоты с солями
К раствору карбоната калия добавьте раствор серной кислоты.
В пробирке наблюдаете _______________________________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
К раствору хлорида бария добавьте немного серной кислоты.
В пробирке наблюдаете _______________________________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Лабораторная работа 6
Тема: Качественные реакции на карбонат, сульфат, хлорид, фосфат анионы.
Цель: Изучить качественные реакции на карбонат, сульфат, хлорид, фосфат анионы.
Оборудование: штатив для пробирок, пробирки.
Реактивы: растворы карбоната калия, сульфата натрия,хлорида натрия, фосфата калия, азотной кислоты, хлорида бария, нитрата серебра
Ход работы:
Инструктаж по ТБ
Выполнение работы.
Опыт1 К раствору карбоната калия добавьте раствор азотной кислоты.
В пробирке наблюдаете _______________________________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Опыт2 К раствору сульфата натрия добавьте раствор хлорида бария
В пробирке наблюдаете _______________________________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Опыт3 К раствору хлорида натрия добавьте нитрат серебра.
В пробирке наблюдаете _______________________________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Опыт4 К раствору фосфата калия добавьте нитрат серебра.
В пробирке наблюдаете _______________________________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Сделайте вывод по лабораторной работе.
Лабораторная работа 7
Тема:Обратимость химических реакций
Цель: Изучить признаки необратимых реакций, научиться определять необратимые химические реакции.
Оборудование: штатив для пробирок, пробирки.
Реактивы: растворы карбоната калия, сульфата натрия, хлорида натрия, серной кислоты, азотной кислоты, хлорида бария, сульфата меди (II), хлорида кальция, сульфата алюминия. гидроксид калия, сульфата железа (II)
Ход работы:
Инструктаж по ТБ
Выполнение работы.
Задание 1 Необратимость ионных реакций а) образование малорастворимых веществ.
В 3 пробирки добавьте по одному мл следующих растворов: № 1 -сульфата меди (II), № 2 - хлорида кальция, № 3 - сульфата алюминия. Добавьте к ним растворы: в первую - гидроксид калия, во вторую - карбонат натрия, в третью - хлорид бария. Запишите наблюдения (цвет и характер осадка).
Пробирка №1 Наблюдения:______________________________________________________________
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Пробирка №2 Наблюдения:______________________________________________________________
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Пробирка №3 Наблюдения:______________________________________________________________
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
б) реакции с образованием газов. В пробирку налейте 1 мл раствора карбоната натрия, Добавьте к ней раствор азотной кислотыВ пробирке наблюдаете __________________________________________
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
в) реакции, идущие с образованием малодиссоциирующих веществ. В пробирку добавьте 1 мл сульфата железа (II) и немного гидроксида калия. Запишите наблюдения. В пробирке наблюдаете __________________
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Прилейте в пробирку азотной кислоты до растворения осадка. В пробирке наблюдаете ____________________
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Сделайте вывод по лабораторной работе.
Лабораторная работа 8
Тема:Получение, собирание и распознавание газов.
Цель: Научиться опытным путем получать, собирать и распознавать различные газы.
Оборудование: пробирки, штатив, газоотводные трубки, лучинка, спиртовка, спички, пробки.
Реактивы: железо, соляная кислота, известняк, известковая вода, пероксид водорода, оксид марганца (IV), растворы сульфата аммония, гидроксида калия, лакмус.
Ход работы:
Инструктаж по ТБ
Выполнение работы.






