S – энтропия – это термодинамическая функция, являющаяся мерой неупорядоченности системы.
Характеристика состояния, основанная на измерении общих параметров системы, то есть P, V и Т, выражает так называемое макросостояние системы. Характеристика системы, основанная на определении координат и скорости каждой частицы, соответствует микросостоянию системы.
Например, в данном объеме при заданных температуре и давлении находятся 2 частицы. Если принять, что P, V и Т – const, то скорости и координаты частиц могут быть самыми разными, главное, чтобы средняя скорость и геометрически усредненное местоположение их были одинаковы. Таким образом, для одного единственного макросостояния возможно много микросостояний и чем их больше, тем больше беспорядочность в данной системе.
Число микросостояний, обеспечивающих данное макросостояние, называется термодинамической вероятностью состояния.
S [Дж/моль×К] = R×lnW, где W – термодинамическая вероятность.
DS = S1 – S0 = R×lnW1/W0
2 Закон термодинамики: состояние системы, предоставленной самой себе, изменяется в направлении состояния, обладающего максимальной термодинамической вероятностью, то есть в сторону увеличения энтропии.
Вторая формулировка: теплота не может сама переходить от холодного тела к горячему. Рисунок.
Энтропия единственная термодинамическая функция, для которой можно измерить ее абсолютное значение. При температуре абсолютного нуля энтропия идеального кристалла равна нулю.
Изменение энтропии в ходе химическое реакции определяется по аналогии с законом Гесса:
аА + bВ = сС + dD;
DS = (сDSС + dDSD) – (aDSA + bDSB)
Энергия Гиббса: G = H – TS или DG = DН – TDS при T = const; P = const.
О направлении химического процесса говорит правило Гиббса: в изолированных закрытых системах принципиально возможно самопроизвольное протекание процессов, для которых значение энергии Гиббса понижается. Для изолированной системы DН = 0, следовательно, DG = –TDS < 0. Чтобы изменение энергии Гиббса было отрицательно, энтропия системы должна увеличиваться, следовательно, самопроизвольно протекают процессы, протекающие с увеличением энтропии.
Как известно, существуют необратимые и обратимые реакции. Тип реакции и ее направление зависит от изменения энтальпии и энтропии процесса. Эту зависимость можно представить в виде таблицы.
| DН | DS | Направление процесса |
| < 0 | > 0 | Необратимо идет прямая реакция |
| > 0 | < 0 | Необратимо идет обратная реакция |
| > 0 | > 0 | Реакция обратима, при повышении Т идет прямая реакция |
| < 0 | < 0 | Реакция обратима, при повышении Т идет обратная реакция |
Стандартные энергии Гиббса образования – это изменение свободной энергии соответствующее синтезу моля вещества из простых веществ при стандартных условиях.
Изменение энергии Гиббса в процессе химической реакции находится по аналогии с правилом Гесса:
аА + bВ = сС + dD;
DG = (сDGС + dDGD) – (aDGA + bDGB)
Изменение энергии Гиббса связано с константой равновесия реакции следующим уравнением: DG = –RTlnK
При вычислении стандартных изменений энтальпии, энтропии и энергии Гиббса обычно используют стандартные энтальпии и Энергии Гиббса образования простых веществ, которые является справочными величинами. Энтальпия образования и энергия Гиббса образования наиболее устойчивых простых веществ равны нулю.
Лекция 9.
Растворы.
Раствор – это гомогенная система переменного состава, состоящая из двух или более компонентов и продуктов их взаимодействия. Компоненты раствора – растворитель и растворенные вещества.
Вообще все дисперсные системы делятся на три группы: грубодисперсные (с диаметром частиц большим, чем 300 нм), коллоидные растворы (диаметр частиц от 1 до 300 нм) и истинные растворы (диаметр частиц меньше 1 нм).
Так как растворы в данном конкретном объеме не обладают постоянным составом, возникло понятие концентрации раствора – это содержание растворенного вещества в единице массы или объема растворителя или раствора. Существует много способов выражения концентрации раствора.
1. Для выражения концентрации по массе используют массовую долю – это массовая доля вещества в 100 г раствора, выражается в %:
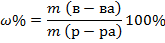
2. Моляльная концентрация – число молей растворенного вещества в 1 кг растворителя, выражается в моль/кг:
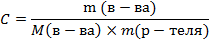
3. Мольная доля раствора – количество данного вещества по отношению к количеству всех веществ, образующих раствор, безразмерная величина:
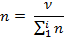
4. Молярная концентрация – количество вещества в 1 л раствора, выражается в моль/л:
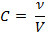
5. Нормальная концентрация – число эквивалентных масс растворенного вещества в 1 л раствора:
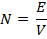
Способность вещества переходить в раствор называется растворимостью вещества. Мера растворимости – концентрация вещества, достигаемая в насыщенном растворе.
Растворимость выражается двумя величинами: к – коэффициент растворимости – количество граммов вещества, растворяющегося в 100 г растворителя. К > 10 – малорастворимые; 10 > к > 1 – умеренно растворимые; 1 > к > 0,01 – малорастворимые; к < 0,01 – практически нерастворимые.
S, моль/л.
Растворимость зависит от следующих факторов.
1. Природы растворенного вещества и природа растворителя: в полярных растворителях хорошо растворяются полярные вещества, в неполярных - неполярные.
2. Температура. Обычно для твердых веществ с повышением температуры растворимость растет. Но есть и исключения: гипс (CaSO4·2H2O). Для растворимости жидкостей в воде нет общих закономерностей.
3. Давление. Влияние давления на растворимость жидкостей и твердых веществ в воде проявляется при давлениях около 10000 атм.
А вот растворимость газов сильно зависит от давления. При постоянной температуре масса газа, растворяющегося в данном объеме жидкости, пропорциональна давлению газа над жидкостью (закон Генри): m = к·Р
По поведению веществ в растворе их разделяют на две большие группы: электролиты – это вещества, диссоциирующие в растворе на ионы; и неэлектролиты, которые на ионы в растворе не диссоциируют.
Наиболее простые растворы образуют неэлектролиты. Растворы неэлектролитов обладают определенным рядом свойств.
1. Давление пара над раствором ниже, чем над растворителем. Количественно данное свойство отражает первый закон Рауля: относительное понижение давления пара раствора равно мольной доле растворенного вещества:
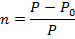
2. Температуры кипения и замерзания растворов. Растворы кипят при температурах более высоких, а замерзают при более низких, чем чистый растворитель. Жидкость кипит только тогда, когда давление пара над жидкостью становится равным внешнему давлению.
Количественно зависимость изменения температур замерзания и кипения от концентрации растворенного вещества выражает 2 закон Рауля: понижение температуры замерзания и повышение температуры кипения раствора прямо пропорционально моляльной концентрации растворенного вещества.
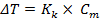
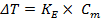
Где КК – криоскопическая константа (1,86 для воды); КЕ - эбулиоскопическая константа (0,52 для воды).
3. Осмос – односторонняя диффузия через полунепроницаемую мембрану. Сила, обуславливающая осмос, называется осмотическим давлением. По закону Вант-Гоффа осмотическое давление раствора равно тому газовому давлению, которое производило бы растворенное вещество, находясь в газообразном состоянии и занимая объем, равный объему раствора: Росм = СRT.
Растворы электролитов сильно отклоняются от законов Рауля и Вант-Гоффа. Поэтому Вант-Гофф предложил ввести изотонический коэффициент i для объяснения этих отклонений.
Лекция 10.
Растворы электролитов.
Поскольку осмотическое давление зависит от числа частиц растворенного вещества, находящихся в единице объема раствора, то шведский ученый Аррениус в 1887 году предположил, что некоторые вещества распадаются в растворе на ионы, что вызывает увеличение числа частиц в растворе.
Для объяснения свойств электролитов Аррениус предложил теорию электролитической диссоциации. Согласно данной теории вещества делятся на две группы: 1) вещества с ионной связью – в узлах кристаллической решетки уже ионы и в растворе разрушается кристаллическая решетка; 2) вещества с полярной ковалентной связью – под действием растворителя происходит ионизация молекул таких веществ.
Для характеристики свойств электролитов используют следующие понятия: степень ионизации и константа ионизации. Степенью ионизации называется отношение распавшихся на ионы формульных единиц вещества к их общему числу в растворе:
На степень ионизации влияет ряд факторов:
1) Природа растворенного вещества. Все электролиты делят на три группы: сильные электролиты (со степенью ионизации больше 0,3 – HCl, NaCl, NaOH); средние электролиты (0,03 < a < 0,3 – HF, H3PO4) и слабые электролиты (a < 0,03 – NH3, CH3COOH).
2) Природа растворителя – чем растворитель менее полярен, тем выше степень ионизации.
HA 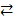 H+ + A-
H+ + A-
Константа ионизации представляет собой константу равновесия процесса ионизации электролита:
Константа ионизации связана со степенью ионизации законом разбавления Оствальда.
Данное уравнение показывает связь между концентрацией электролита и степенью его диссоциации: степень диссоциации возрастает при разбавлении раствора. Процесс диссоциации – процесс равновесный, при разбавлении равновесие сдвигается в сторону образования ионов. И, наоборот, при увеличении концентрации степень диссоциации падает. И даже для сильных электролитов реальная (кажущаяся) степень диссоциации меньше единицы и с увеличением концентрации снижается.
Для оценки действительной степени диссоциации ионов пользуются не концентрацией, а активностью: a = f×C, где f – коэффициент активности.
Коэффициент активности зависит от концентраций ионов, присутствующих в растворе, а точнее, от ионной силы раствора:
Согласно современным представлениям, кислотой является донор протона, то есть частица, способная отдавать протон, а основанием – акцептор протона, то есть частица, способная присоединять протон. Соотношение между кислотой и основанием определяется схемой:
Основание + Протон = Кислота
Связанные данным соотношение кислота и основание называются сопряженными. В зависимости от условий любая кислота может выступать также и в роли основания при реакции с более сильной кислотой.
Чистая вода ослабляет электрический ток в 81 раз, но все же обладает определенной электропроводностью, которая объясняется диссоциацией воды на катионы водорода и гидроксид-анионы:
Н+ и ОН– ⇄ Н2О
Концентрация Н+ и ОН– была вычислена по величине электропроводности дистиллированной воды. При 25 0С они равны 10-7 моль/л. константа диссоциации воды выглядит следующим образом:
Концентрация молекул воды равна 55,55 моль/л. Произведение концентраций Н+ и ОН– является величиной постоянной и называется ионным произведением воды (равно 10-14). В чистой воде концентрации равны. Такой раствор называется нейтральным. В кислом растворе концентрация катионов водорода > 10-7, а в щелочном < 10-7 моль/л. Для удобства выражения концентрацию катионов водорода выражают через ее отрицательный десятичный логарифм и называется водородным показателем и обозначается рН = –lg[Н+]. Таким образом, для нейтрального раствора рН = 7, для кислых растворов рН < 7, для щелочных рН > 7.
Процесс диссоциации процесс равновесный, поэтому смещение равновесия процесса диссоциации подчиняется принципу Ле Шателье. Поэтому можно сделать следующий вывод. Обязательным условием завершенности реакции между электролитами является удаление из раствора каких-либо ионов вследствие образования слабодиссоциирующих веществ (слабых электролитов) или веществ, выделяющихся из раствора в виде газа или осадка. Образование таких веществ сдвигает равновесие в сторону образования продуктов реакции.
Примеры реакций.
Лекция 11.






