«адача 1. “ермохимическое уравнение реакции
√азообразный этиловый спирт можно получить при взаимодействии этилена и вод€ных паров. Ќапишите термохимическое уравнение этой реакции, вычислив его тепловой эффект. —колько теплоты выделитс€, если в реакцию вступило 10 л этилена при н.у.?
–ешение: —оставим термохимическое уравнение реакции:
—2Ќ4(r) + H2O(r) = C2H5OH(r) DHхр =?
—огласно следстви€ закона √есса:
DЌхр = DH—2Ќ5ќЌ(r) - DHC2H4(r) - DHH2O(r)
ѕодставл€ем значени€ DЌ из таблицы:
DЌхр = -235,31 Ц 52,28 Ц (-241,84) = -45,76кƒж
ќдин моль этилена (н.у.) занимает объем 22,4 л. »сход€ из следстви€ закона јвогардо, можно составить пропорцию:
22,4 л —2Ќ4¾ 45,76 кƒж
10 л —2Ќ4¾DЌхр DЌхр =20.43 кƒж
≈сли в реакцию вступило 10 л —2Ќ4, то выдел€етс€ 20,43кƒж теплоты.
ќтвет:20,43кƒж теплоты.
«адача 2. ќпределение энтальпии реакции
ќпределить изменение энтальпии химической реакции и ее тепловой эффект.
2NaOH + H2SO4 = Na2SO4 + 2H2O
–ешение:
ѕо справочнику определим энтальпии образовани€ компонентов.
ΔH0(NaOH) = -426 кƒж/моль.
ΔH0(H2SO4) = -813 кƒж/моль.
ΔH0(H2O) = -285 кƒж/моль.
ΔH0(Na2SO4) = -1387 кƒж/моль.
ѕо следствию из закона √есса определим изменение энтальпии реакции:
ΔHх.р. = [ΔH(Na2SO4) + 2ΔH(H2O)] - [ΔH(H2SO4) + 2ΔH(NaOH)] =
= [-1387 + 2(-285)] - [-813 + 2(-426)] = - 1957 - (-1665) = - 292 кƒж/моль.
ќпределим тепловой эффект:
Q = - ΔHх.р. = 292 кƒж.
ќтвет: 292 кƒж.
«адача 3. √ашение извести описываетс€ уравнением: —аќ + Ќ2ќ = —а(ќЌ)2.
ΔHх.р. = - 65 кƒж/моль. ¬ычислить теплоту образовани€ оксида кальци€, если ΔH0(H2O) = -285 кƒж/моль,
ΔH0(Ca(OH)2) = -986 кƒж/моль.
–ешение:
«апишем по закону √есса:
ΔHх.р. = ΔH0(Ca(OH)2) - ΔH0(H2O) - ΔH0(CaO)
ќтсюда,
ΔH0(CaO) = ΔH0(Ca(OH)2) - ΔH0(H2O) - ΔHх.р. = - 986 - (-285) - (-65) = - 636 кƒж/моль.
ќтвет: - 636 кƒж/моль.
«адача 4. –ассчитайте энтальпию образовани€ сульфата цинка из простых веществ при T = 298 K на основании следующих даных:
ZnS = Zn + S ΔH1 = 200,5 кƒж
2ZnS + 3O2 = 2ZnO + 2SO2 ΔH2 = - 893,5 кƒж
2SO2 + O2 = 2SO3 ΔH3 = - 198,2 кƒж
ZnSO4 = ZnO + SO3 ΔH4 = 235,0 кƒж
–ешение:
»з закона √есса следует, что, поскольку путь перехода не важен, расчеты подчин€ютс€ алгебраическим правилам работы с обычными уравнени€ми. »ными словами, их можно "тасовать" как угодно. ѕопробуем применить эту возможность.
Ќам необходимо прийти к уравнению:
Zn + S + 2O2 = ZnSO4.
ƒл€ этого скомпонуем имеющийс€ "материал" так, чтобы слева оказались Zn, S, O2, а справа - сульфат цинка. ѕеревернем первое и четвертое уравнение слева направо, а во втором и третьем разделим коэффициенты на 2.
ѕолучим:
Zn + S = ZnS
ZnS + 1,5O2 = ZnO + SO2
SO2 + 0,5O2 = SO3
ZnO + SO3 = ZnSO4.
“еперьпопростусложимправыечастиилевыечасти.
Zn + S + ZnS + 1,5O2 + SO2 + 0,5O2 + ZnO + SO3 = ZnS + ZnO + SO2 + SO3 + ZnSO4
„тобудетравно
Zn + S + 2O2 + ZnS + SO2 + SO3 + ZnO = ZnS + SO2 + SO3 + ZnO + ZnSO4
|
|
|
¬идно, да, чтополучаетс€? ¬се подчеркнутое сокращаем (оп€ть же, чиста€ арифметика!)
» имеем в итоге
Zn + S + 2O2 = ZnSO4 - что и требовалось.
“еперь применим тот же принцип и к энтальпи€м. ѕервую и четвертую реакции перевернули, значит, энтальпии получат противоположный знак. ¬торую и третью делим пополам (поскольку делили коэффициенты).
ΔH = - 200,5 + (-893,5/2) + (-198,2/2) + (-235,0) = - 981,35 кƒж/моль.
ќтвет:- 981,35 кƒж/моль.
«адача 5. ¬ычислите энтальпию реакции полного окислени€ этилового спирта до уксусной кислоты, если энтальпи€ образовани€ всех веществ, участвующих в реакции, равны:
∆Ќº обр. —2Ќ5ќЌ ж = - 277 кƒж/моль;
∆Ќº обр. —Ќ3—ќќЌ ж = - 487 кƒж/моль;
∆Ќº обр. Ќ2ќ ж = - 285,9 кƒж/моль;
∆Ќº обр. ќ2 = 0
–ешение: –еакци€ окислени€ этилового спирта:
—2Ќ5ќЌ + ќ2 = —Ќ3—ќќЌ + Ќ2ќ
»з закона √есса следует, что ∆Ќр-ции = (∆Ќºобр. —Ќ3—ќќЌ + ∆Ќº обр. Ќ2ќ) Ц
(∆Ќº обр. —2Ќ5ќЌ + ∆Ќº обр. ќ2) = - 487 Ц 285,9 + 277,6 = - 495,3 кƒж.
«адача 6. ќпределение теплоты сгорани€
¬ычислите теплоту сгорани€ этилена —2Ќ4(г) + 3O2 = 2—O2(г) + 2H2O(г) если теплота его образовани€ равна 52,3 кƒж/моль. аков тепловой эффект сгорани€ 5 л. этилена?
–ешение:
ќпределим изменение энтальпии реакции по закону √есса.
ѕо справочнику определим энтальпии образовани€ компонентов, кƒж/моль:
ΔH0(C2H4(г)) = 52.
ΔH0(CO2(г)) = - 393.
ΔH0(H2O(г)) = - 241.
ΔHх.р. = [2*(-393) + 2*(-241)] - [52,3 + 0] = -1320 кƒж/моль.
оличество выделившегос€ тепла при сгорании 1 моль этилена Q = - ΔHх.р. = 1320 кƒж
оличество теплоты, выдел€ющейс€ при сгорании 5 л. этилена:
Q1 = Q * V / Vm = 1320 * 5 / 22,4 = 294,6 кƒж.
ќтвет:294,6 кƒж.
«адача 7. “емпература наступлени€ равновеси€
ќпределить температуру, при которой наступит равновесие системы:
CH4(г) + CO2(г) = 2CO (г) + 2H2(г)
ΔHх.р. = + 247,37 кƒж.
–ешение:
ритерием возможности протекани€ химической реакции служит энерги€ √иббса, ΔG.
ΔG < 0, реакци€ возможна.
ΔG = 0, порог возможности.
ΔG > 0, реакци€ невозможна.
— энтальпией и энтропией энерги€ √иббса св€зана соотношением:
ΔG = ΔH - TΔS.
ќтсюда, дл€ наступлени€ равновеси€ (достижени€ порога), должно выполнитьс€ соотношение:
T = ΔH/ΔS
ќпределим изменение энтропии по следствию из закона √есса.
CH4(г) + CO2(г) = 2CO (г) + 2H2(г)
ΔS0х.р. = [2*S0(CO) + 2*S0(H2)] - [S0(CH4) + S0(CO2)]
¬ыписав из справочника соотв. значени€, решаем:
ΔS0х.р. = (2*198 + 2*130) - (186 + 213) = 656 - 399 = 257 ƒж/моль* = 0,257 кƒж/моль* .
T = ΔH/ΔS = 247,37/0,257 = 963 о .
ќтвет:963 о .
«адача 8. «нак изменени€ энтропии
Ќе производ€ вычислений, определить знак изменени€ энтропии процессов:
1. H2O(г) ---> H2O(ж)
2. 2H2S + O2 = 2S(тв.) + 2H2O(ж)
3. (NH4)2CO3(тв.) = 2NH3 + CO2 + H2O (все продукты газообразны).
–ешение:
ѕоскольку энтропи€ - мера неупор€доченности системы, то выполн€етс€ обща€ закономерность:
S(тв.) < S(жидкость) < S(газ).
¬ свете этого проанализируем задачу.
1. »з газа конденсируетс€ жидкость.
ѕоскольку S(жидкость) < S(газ), ΔS < 0.
2. »з 3 моль газов получаетс€ 2 моль тв. вещества и 2 моль жидкости.
ќчевидно, что ΔS < 0.
3. »з твердого вещества получаютс€ газы.
ѕоскольку S(тв.) < S(газ), ΔS > 0.
|
|
|
«адача 9. ¬озможность процесса
«аданы услови€:
1. ΔS < 0, ΔH < 0
2. ΔS < 0, ΔH > 0
3. ΔS > 0, ΔH < 0
4. ΔS > 0, ΔH > 0
ѕроанализировать возможность протекани€ реакции.
–ешение:
¬ решении будем опиратьс€ на формулу: ΔG = ΔH - TΔS. (ѕодробнее - см. задача є 7).
1. ѕри ΔS < 0, ΔH < 0.
ѕервое слагаемое формулы (ΔH) меньше нул€, а второе, за счет отрицательного знака энтропии, больше нул€
(-T(-ΔS) = +TΔS). ¬озможность реакции будет определ€тьс€ соотношением величин первого и второго слагаемого. ≈сли значение энтальпии (по модулю) будет больше произведени€ TΔS, (|ΔH| > |TΔS|), т.е. в целом энерги€ √иббса будет меньше нул€, реакци€ возможна.
2. ΔS < 0, ΔH > 0.
» первое, и второе слагаемое больше нул€. Ёнерги€ √иббса больше нул€. –еакци€ невозможна.
3. ΔS > 0, ΔH < 0.
ѕервое слагаемое меньше нул€, второе - тоже. Ёнерги€ √иббса меньше нул€, реакци€ возможна.
4. ΔS > 0, ΔH > 0
ѕервое слагаемое формулы (ΔH) больше нул€, а второе, за счет положительного знака энтропии, больше нул€
(-T(+ΔS) = - TΔS). ¬озможность реакции будет определ€тьс€ соотношением величин первого и второго слагаемого. ≈сли значение энтальпии (по модулю) будет больше произведени€ TΔS, (|ΔH| > |TΔS|), т.е. в целом энерги€ √иббса будет больше нул€, реакци€ невозможна. ќднако, с ростом температуры будет расти (по модулю) второе слагаемое, и за определенным пределом температуры реакци€ станет возможна.
ќтвет: 1 Ц возможна; 2 - невозможна.; 3 Ц возможна; 4 Ц возможна.
«адача 10. Ќа основании стандартных теплот образовани€ и абсолютных стандартных энтропий соответствующих веществ вычислить DGo298 реакции —ќ(г) + H2O(ж) = —ќ2(г) + Ќ2(г) ¬озможна ли эта реакци€ при стандартных услови€х?
–ешение: DGо определ€ем из уравнени€ DGo=DHo-TDSo
DHхр = DЌ—ќ2 - DЌ—ќ - DЌЌ2ќ (ж) == -393,51 Ц (110,52) Ц (-285,84) = -218,19 кƒж.
DSхр = SCO2 + SH2 - SCO Ц SH2O (ж) = = 213,65+130,59Ц197,91Ц69,94=76,39 ƒж/моль×
или 0,07639 кƒж.
DG = -218,19 Ц 298 × 0,07639 = -240,8 кƒж
DG<0, значит реакци€ возможна.
ќтвет:реакци€ возможна.
 ¬арианты контрольных заданий
¬арианты контрольных заданий
¬ариант 1
1. ак вычислить изменение энергии √иббса в реакции по термодинамическим характеристикам исходных веществ и продуктов реакции?
2. ¬ычислите тепловой эффект реакции восстановлени€ оксида железа (II) водородом, исход€ из следующих термохимических уравнений:
FeO(к) + —ќ(г) = Fe(к) + —ќ2(г); ∆Ќ1 = -13,18 кƒж;
—ќ(г) + 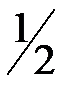 ќ2(г) = —ќ2(г); ∆Ќ2 = -283,0 кƒж;
ќ2(г) = —ќ2(г); ∆Ќ2 = -283,0 кƒж;
Ќ2(г) + 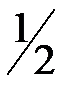 ќ2(г) = Ќ2ќ(г); ∆Ќ3 = -241,83 кƒж.
ќ2(г) = Ќ2ќ(г); ∆Ќ3 = -241,83 кƒж.
ќтвет: +27,99 кƒж.
¬ариант 2
1. аковы термодинамические услови€ самопроизвольного протекани€ химической реакции?
2. √азообразный этиловый спирт —2Ќ5ќЌ можно получить при взаимодействии этилена —2Ќ4(г) и вод€ных паров. Ќапишите термохимическое уравнение этой реакции, предварительно вычислив ее тепловой эффект. ќтвет: -45,76 кƒж.
¬ариант 3
1. „то называетс€ термохимическим уравнением? ѕочему в нЄм необходимо указывать агрегатное состо€ние веществ и их полиморфные модификации?
2. ристаллический хлорид аммони€ образуетс€ при взаимодействии газообразных аммиака и хлороводорода. Ќапишите термохимическое уравнение этой реакции, предварительно вычислив ее тепловой эффект. —колько теплоты выделитс€, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные услови€? ќтвет: 78,97 кƒж.
¬ариант 4
1. аковы две системы знаков тепловых эффектов?
2. “епловой эффект реакции сгорани€ жидкого бензола с образованием паров воды и диоксида углерода равен -3135,58 кƒж. —оставьте термохимическое уравнение этой реакции и вычислите теплоту образовани€ —6Ќ6(ж). ќтвет: +49,03 кƒж.
¬ариант 5
|
|
|
1. „то называетс€ стандартной теплотой (энтальпией) образовани€ соединени€? акие услови€ называютс€ стандартными?
2. Ќапишите термохимическое уравнение реакции между —ќ(г) и водородом, в результате которой образуютс€ —Ќ4(г) и Ќ2ќ(г). —колько теплоты выделитс€ при этой реакции, если было получено 67,2 л метана в пересчете на нормальные услови€? ќтвет: 618,48 кƒж.
¬ариант 6
1. —формулируйте закон √есса и следствие из этого закона. акова взаимосв€зь закона √есса и закона сохранени€ энергии?
2. ¬осстановление Fe3O4 оксидом углерода идет по уравнению
Fe3O4(к) + CO(г) = 3FeO(к) + CO2(г).
¬ычислите ∆G0298 и сделайте вывод о возможности самопроизвольного протекани€ этой реакции при стандартных услови€х. „ему равно ∆S0298 в этом процессе? ќтвет: +24,19 кƒж; +31,34 ƒж/ .
¬ариант 7
1. ¬ каком направлении самопроизвольно протекают химические реакции? „то €вл€етс€ движущей силой химического процесса?
2. ѕри сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кƒж теплоты. Ќапишите термохимическое уравнение реакции, в результате которой образуютс€ пары воды и диоксид углерода. ¬ычислите теплоту образовани€ —2Ќ5ќЌ(ж). ќтвет: -277,67 кƒж.
¬ариант 8
1. „то такое изобарно Ц изотермический потенциал химической реакции и как он св€зан с изменением энтальпии и энтропии реакции?
2. “епловой эффект реакции 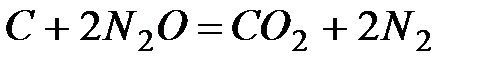 равен Ц560,0 кƒж. ¬ычислите стандартную теплоту образовани€
равен Ц560,0 кƒж. ¬ычислите стандартную теплоту образовани€ 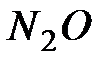 . ќтвет: 83,24 кƒж/моль.
. ќтвет: 83,24 кƒж/моль.
¬ариант 9
1. „то такое энтропи€ реакции?
2. »сход€ из значений стандартных теплот образовани€ и абсолютных стандартных энтропий соответствующих веществ, вычислите ∆G0298 реакции, протекающей по уравнению NH3 (г) + HCl(г) = NH4Cl(к). ћожет ли эта реакци€ при стандартных услови€х идти самопроизвольно? ќтвет: -92,08 кƒж.
¬ариант 10
1. ак измен€етс€ энтропи€ с увеличением движени€ частиц в системе?
2. ѕользу€сь значени€ми 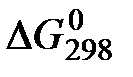 реагирующих веществ, вычислите
реагирующих веществ, вычислите 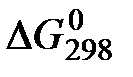 реакции
реакции 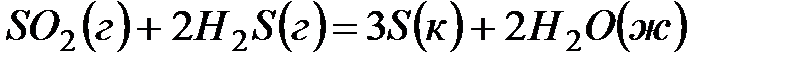 и определите, может ли она осуществитьс€ при стандартных услови€х.
и определите, может ли она осуществитьс€ при стандартных услови€х.
¬ариант 11
1. ќсновные ѕон€ти€ термодинамики: система, фаза, виды систем, параметры состо€ни€ систем, виды процессов.
2. ќпределить энтальпию реакции спиртового брожени€ глюкозы
—6Ќ12ќ6 2—2Ќ5ќЌ + 2—ќ2
ферменты
∆Ќº 298 (—6Ќ12ќ6) = - 1273,0 кƒж/моль
∆Ќº 298 (—2Ќ5ќЌ) = - 1366,91 кƒж/моль
∆Ќº 298 (—ќ2) = - 393,5 кƒж/моль
¬ариант 12
1. ѕервый закон термодинамики дл€ изохорного и изобарного процессов. Ёнтальпи€.
2. ќпределить энтальпию реакции: NH3(г) + Ќ—l (г) = NH4Cl (“)
∆Ќº 298 (ЌCl) = - 92,3 кƒж/моль
∆Ќº (NЌ3) = - 46,2 кƒж/моль
∆Ќº (NH4Cl) = - 313,6 кƒж/моль
¬ариант 13
1. “ермохими€: экзо- и эндотермические реакции. “ермохимические уравнени€, их особенности.
2. ќпределите кака€ из данных реакций экзо-, а кака€ эндотермическа€ реакци€? ќтвет обоснуйте.
N2 + O2D 2NO ∆Ќ = + 80 кƒж
N2 + 3H2D 2NO3 ∆Ќ = - 88 кƒж
¬ариант 14
1.„то такое параметры системы? акие параметры ¬ы знаете?
2. ¬ычислить энтальпию образовани€ газообразного серного ангидрида,если при сгорании 16 г.серы выделилось 197.6 кƒж тепла.
¬ариант 15
1. ѕеречислить функции состо€ни€ системы.
2. ѕри какой температуре наступит равновесие системы
4HCl(г) + ќ2(г) ↔ 2Ќ2ќ(г) + 2—l2(г); ∆Ќ =-114,42 ƒж.
’лор или кислород в этой системе €вл€етс€ более сильным окислителем и при какой температуре? ќтвет: 891 .
¬ариант 16
1. акие типы термодинамических процессов ¬ы знаете?
2. „ем можно объ€снить, что при стандартных услови€х невозможна экзотермическа€ реакци€ Ќ2 (г) + —ќ2(г) = —ќ(г) + Ќ2ќ(ж); ∆Ќ = -2,85 кƒж. «на€ тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите ∆G0298 этой реакции. ќтвет: -19,91 кƒж.
|
|
|
¬ариант 17
1. «акон √есса и следстви€, вытекающие из него.
2. ќпределите 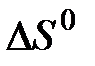 системы
системы 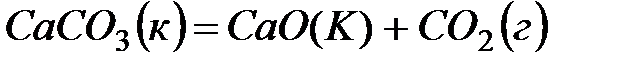 . ќтвет: 160,4 ƒж/(мольЈ ).
. ќтвет: 160,4 ƒж/(мольЈ ).
¬ариант 18
1. „ем отличаетс€ энтальпи€ образовани€ вещества от энтальпии реакции?
2. ¬ычислите ∆Ќ0,∆S0,∆G0“ реакции, протекающей по уравнению Fe2O3(к) + 3Ќ2(г) = 2Fe(к) + 2Ќ2ќ(г). ¬озможна ли реакци€ восстановлени€ Fe2O3 водородом при 500 и 2000 ? ќтвет: +96,61 кƒж; 138,83 ƒж/ ; 27,2 кƒж; -181,05 кƒж.
¬ариант 19
1. акие процессы сопровождаютс€ увеличением энтропии?
2. “епловой эффект какой реакции равен теплоте образовани€ метана? ¬ычислите теплоту образовани€ метана, исход€ из следующих термохимических уравнений:
Ќ2(г) + 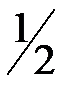 ќ2(г) = Ќ2ќ; ∆Ќ1 = -285,84 кƒж;
ќ2(г) = Ќ2ќ; ∆Ќ1 = -285,84 кƒж;
—(к) + ќ2(г) = —ќ2(г); ∆Ќ2 = -393,51 кƒж;
—Ќ4(г) + 2ќ2(г) = 2Ќ2ќ(ж) + —ќ2(г); ∆Ќ3 = -890,31 кƒж.
ќтвет: -74,88 кƒж.
¬ариант 20
1. акие процессы сопровождаютс€ увеличением энтропии?
2. ѕодсчитав 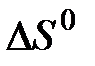 реакции, определите, кака€ из двух реакций термодинамически возможна:
реакции, определите, кака€ из двух реакций термодинамически возможна: 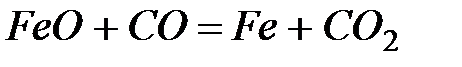 ;
; 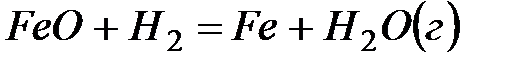 .
.
¬ариант 21
1. „то называетс€ стандартной энтальпией образовани€?
2. Ќа основании стандартных теплот образовани€ и абсолютных стандартных энтропий соответствующих веществ вычислите ∆G0298 реакции, протекающей по уравнению —ќ2(г) + 4Ќ2(г) = —Ќ4(г) + 2Ќ2ќ(ж). ¬озможна ли эта реакци€ при стандартных услови€х? ќтвет: -130,89 кƒж.
¬ариант 22
1. аков знак ∆ G процесса та€ни€ льда при 263 ?
2. ”меньшаетс€ или увеличиваетс€ энтропи€ при переходах а) воды в пар; б) графита в алмаз? ѕочему? ¬ычислите ∆S0298 дл€ каждого превращени€. —делайте вывод о количественном изменении энтропии при фазовых и аллотропических превращени€х. ќтвет: а) 118,78 ƒж/(моль∙ ); б) -3,25 ƒж/(моль∙ ).
¬ариант 23
1. аков знак ∆ H процесса горени€ угл€?
2. ѕри стандартных услови€х реакци€ 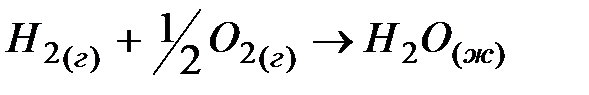 протекает самопроизвольно. ќпределите знаки ∆Ќи ∆S в этой системе.
протекает самопроизвольно. ќпределите знаки ∆Ќи ∆S в этой системе.
¬ариант 24
1. аков знак ∆ S процесса сублимации Усухого льдаФ?
2. ¬ычислите ∆Ќќ,∆Sќ,∆Gќ“ реакции, протекающей по уравнению TiO2(к) +2C(к) = Ti(к) + 2—ќ(г). ¬озможна ли реакци€ восстановлени€ TiO2 углеродом при 1000 и 3000 ? ќтвет: +722,86 кƒж; 364,84 ƒж/ ; +358,02 кƒж; -371,66 кƒж.
¬ариант 25
1. аков знак изменени€ энтропии в процессе кипени€ воды?
2. Ќайдите изменение внутренней энергии при испарении 75г этилового спирта при температуре кипени€, если удельна€ теплота его испарени€ равна 857,7 ƒж/г, а удельный объем пара при температуре кипени€ равен 607 см3/г. ќбъемом жидкости пренебречь. ќтвет: 58,39 кƒж.
¬ариант 26
1. II закон термодинамики. “еорема арно - лаузиуса.
2. –ассчитайте расход тепловой энергии при реакции 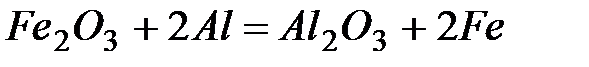 , если было получено 336г железа. ќтвет: Ц2561,0 кƒж.
, если было получено 336г железа. ќтвет: Ц2561,0 кƒж.
¬ариант 27
1. III закон термодинамики.
2. –еакци€ горени€ ацетилена протекает по уравнению
—2Ќ2(г) + 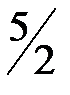 ќ2 (г) = 2—ќ2(г) + Ќ2ќ(ж)
ќ2 (г) = 2—ќ2(г) + Ќ2ќ(ж)
¬ычислите ∆G0298 и ∆S0298. ќбъ€сните уменьшение энтропии в результате этой реакции. ќтвет: -1235,15 кƒж; -216,15 ƒж/(моль∙ ).
¬ариант 28
1. “еорема Ќернста.
2. ѕри сгорании газообразного аммиака образуютс€ пары воды и оксид азота. —колько теплоты выделитс€ при этой реакции, если было получено 44,8 л NO в пересчете на нормальные услови€? ќтвет: 452,37 кƒж.
¬ариант 29
1. ѕостулат ѕланка.
2. ѕри какой температуре наступит равновесие системы
—Ќ4(г) + —ќ2(г) ↔ 2—ќ(г) + 2Ќ2(г); ∆Ќ = +247,37 кƒж?
¬ариант 30
1. ќсновы термодинамических расчетов
2. ѕодсчитав тепловой эффект и изменение энергии √иббса при 25ºC дл€ реакции 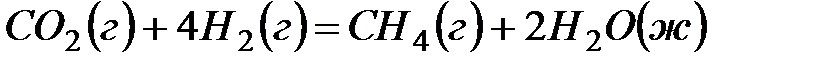 , определите
, определите 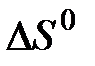 дл€ этой реакции. ќтвет: Ц412,4 ƒж/(мольЈ ).
дл€ этой реакции. ќтвет: Ц412,4 ƒж/(мольЈ ).






