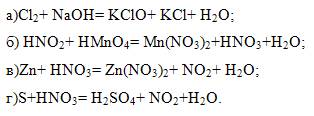Классификация анионов на аналитические группы:
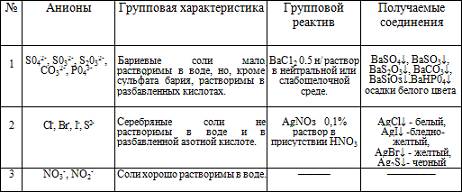
Первая аналитическая группа анионов:SO42-, SO32-. S2O32-, CO32-, SiO32-, PO43-
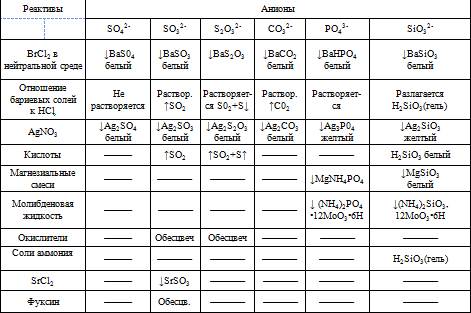
Все анионы первой группы образуют соли бария, нерастворимые в воде, но растворимые в разбавленных кислотах (за исключением сульфата бария).Поэтому групповым реактивом первой группы является хлорид бария в нейтральном или слабо щелочном растворе. Серебряные соли, образуемые анионами 1 группы, в отличие от 2 группы растворимы в разбавленных кислотах, а сульфат серебра даже в воде.
Большинство солей серной кислоты хорошо растворяется в воде. К нерастворимым относятся только сульфаты бария, стронция, кальция, свинца. Сульфит-ион в растворе неустойчив и постепенно окисляется до сульфат-иона. К растворимым тиосульфатам относятся соли щелочных металлов, стронция, цинка, кадмия. Из средних солей угольной кислоты растворимы только карбонаты натрия, кадмия и аммония. Соли фосфорной кислоты в основном в воде нерастворимы. Исключение составляют фосфаты щелочных металлов и аммония и дигидрофосфаты щелочноземельных металлов. Все фосфаты растворяются в минеральных кислотах, а многие (кроме фосфатов железа и аммония) также в уксусной кислоте. Из силикатов растворимы в воде лишь соли щелочных металлов метакремниевой кислоты, которые называются "растворимыми стеклами". Водные растворы этих солей вследствие гидролиза имеют сильно щелочную реакцию. Часть нерастворимых силикатов разлагается минеральными кислотами с образованием свободных кремниевых кислот. Все анионы первой группы в растворах бесцвет.
Объектами качественного анализа на присутствие анионов 1 группы являются почвы, природные воды, растения, биологические жидкости.
Реакции анионов первой группы:
Анионы второй аналитической группы: Cl-, Br-, I-, S2-
Большинство солей, образуемых анионами второй группы, растворимы в воде.
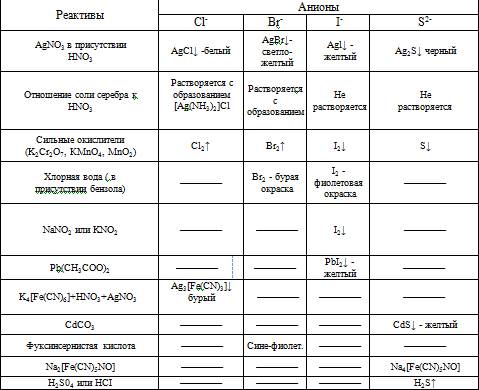
Исключение составляют соли серебра, ртути и свинца. Групповой реактив на вторую группу анионов - нитрат серебра в присутствии азотной кислоты, который образует с анионами второй группы серебряные соли, не растворимые в воде и, в отличие от анионов первой группы, не растворимые в разбавленной азотной кислоте.
Хлорид бария, групповой реактив анионов первой группы, анионы второй группы не осаждает. Все анионы второй группы бесцветны.
Хлорид - ионы всегда присутствуют в почвах и в природных водах. Количество хлорид-ионов в питьевой воде не должно превышать 40мг на 1 литр. Многие хлориды используются в качестве удобрений: хлорид аммония и калия, сильвинит (KCI•NaCI) каинит (КСI•МgSО4•ЗН2О). Хлорид натрия (поваренная соль) обязательный компонент рациона человека и животных, является активатором многих пищеварительных ферментов. Соляная кислота, содержащаяся в желудочном соке млекопитающих, участвует в процессе переваривания белков, активируя фермент пепсин. Хлориды бария и ртути (II) применяют как сельскохозяйственные яды. Иодид-ионы содержатся в питьевой воде и продуктах питания и играют огромную роль в процессах жизнедеятельности. Большое количество йода накапливается в щитовидной железе, секретирующей йодсодержащие гормоны. Бромиды используются в медицине как средства, успокаивающие центральную нервную систему. Сероводород образуется при разложении белковых соединений. Он очень ядовит, его вдыхание может вызвать потерю сознания и паралич дыхательного центра. Поэтому все работы с сероводородом проводятся под тягой.
Реакции анионов второй группы:
Анионы третьей аналитической группы: NO3-, NO2-
Соли анионов третьей аналитической группы, включая бариевые и серебряные, хорошо растворимы в воде. Поэтому группового реактива на анионы этой группы нет. Для открытия нитрат- и нитрит-ионов применяют не реакции осаждения, а окислительно-восстановительные реакции, в которых эти анионы выступают как активные окислители. Нитраты образуются в большом количестве в природе в результате нитрификации, т.е. процесса биологического превращения аммиака в окисленные неорганические соединения. Этот процесс происходит в почве и воде и осуществляется бактериями - нитрификаторами. Промежуточным продуктом химических реакций окисления аммиака являются нитриты, а конечным - нитраты. В результате этого нитраты всегда содержатся в природных водах. Предельно допустимое содержание нитратов в питьевой воде составляет 20 мг/л. Содержание нитритов в питьевой воде вообще не допустимо. Однако в результате применения больших количеств аммонийных удобрений происходит накопление и нитратов и нитритов в почвах, водах и продукции растениеводства. Кроме того, нитраты широко используются в консервной и мясоперерабатывающей промышленности в качестве добавок, сохраняющих цвет продукции. Токсическое действие нитратов и нитритов обусловлено блокадой железа в железосодержащих дыхательных ферментах, что приводит к острой гипоксии тканей и может закончиться летально. Поэтому овощи, фрукты, колбасы, копчености, консервы мясные и плодоовощные подлежат обязательному анализу на содержание нитратов и нитритов.
Реакции анионов 3 группы:

Вопросы для самопроверки:
1. Что лежит в основе разделения анионов на группы и чем каждая характеризуется?
2. Чем существенно отличается анализ катионов от анализа анионов, какую роль играют групповые реактивы?
3. Как открывается ион SO42- в присутствии других ионов первой группы? Ответ пояснить.
4. Как открыть ион Cl-? Ответ подтвердить уравнениями реакций.
5. Расставить коэффициенты в уравнениях: