’»ћ»„≈— јя “≈–ћќƒ»Ќјћ» ј
«адача 1. —тандартные энтальпии образовани€ жидкой и газообразной воды при 298 равны -285,8 и -241,8 кƒжЈмоль-1, соответственно. –ассчитайте энтальпию испарени€ воды при этой температуре.
«адача 2. –ассчитайте энтальпию реакции 6—(г) + 6Ќ(г) = —6Ќ6 (г)
а) по энтальпи€м образовани€; б) по энерги€м св€зи, в предположении, что двойные св€зи в молекуле —6Ќ6 фиксированы.
DfHo(C6H6(г)) = 82,93 кƒж/моль; DfHo(C(г)) = 716,68 кƒж/моль; DfHo(Ќ(г)) = 217,97 кƒж/моль; ≈(—-Ќ) = 412 кƒж/моль; ≈ (—-—)=348 кƒж/моль; ≈(—=—)=612 кƒж/моль.
«адача 3. ѕользу€сь справочными данными, рассчитайте энтальпию реакции при 298 .
3Cu (т) + 8HNO3 (aq) = 3Cu(NO3)2 (aq) + 2NO (г) + 4H2O (ж)
DfHo(Ќ2ќ(ж)) =-285,8 кƒж/моль; DfHo(NO(г))= 90,25 кƒж/моль; DfHo(Cu 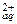 ) = 64,77 кƒж/моль; DfHo(NO
) = 64,77 кƒж/моль; DfHo(NO 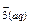 )= -205 кƒж/моль;
)= -205 кƒж/моль;
«адача 4. –ассчитайте энтальпию сгорани€ метана при 1000 , если даны энтальпи€ образовани€ при 298 :
Δ fЌо (CH4) = Ц 17,9 ккалЈмоль-1,
Δ fЌо (Cќ2) = Ц 94,1 ккалЈмоль-1,
Δ fЌо (Ќ2ќ(г)) = Ц 57,8 ккалЈмоль-1.
“еплоемкости газов (в калЈмоль-1Ј -1) в интервале от 298 до 1000 равны:
—р (—Ќ4) = 3,422 + 0,0178Ј“, —р (ќ2) = 6,095 + 0,0033Ј“,
—р (—ќ2) = 6,396 + 0,0102Ј“, —р (Ќ2ќ(г)) = 7,188 + 0,0024Ј“,
«адача 5. аков стандартный тепловой эффект реакции
Fe2O3 (т) + 2Al(т) = 2Fe(т) + Al2O3 (т) Δ Ќо 298 ,
если стандартна€ теплота образовани€ Al2O3(т) равна -1670 кƒж/моль, а Fe2O3(т) равна -821 кƒж/моль?
«адача 6. —тандартные теплоты образовани€ из элементов сульфата меди CuSO4 и воды соответственно равны -771 и -286 кƒж/моль, а теплота образовани€ гидратированной соли CuSO4Ј5H2O и теплота растворени€ ее в воде составл€ют - 2280 и 11,7 кƒж/моль. „ему равен тепловой эффект растворени€ в воде 1 кмоль безводной соли?
«адача 7. ѕо стандартным тепловым эффектам сгорани€ этилового спирта —2Ќ5ќЌ - 1370, уксусной кислоты —Ќ3—ќќЌ - 876 и этилацетата —Ќ3—ќќ—2Ќ5 - 2250 кƒж/моль рассчитайте стандартный тепловой эффект реакции получени€ этилацетата: —2Ќ5ќЌ + —Ќ3—ќќЌ = —Ќ3—ќќ—2Ќ5 + Ќ2ќ.
«адача 8. «ависимость теплоемкости сухих корней стальника от температуры можно выразить уравнением —р = -2,53 + 0,01Ј“ ƒж/(гЈ ). акое количество теплоты необходимо дл€ нагревани€ 100 г корней стальника от 353 до 373 .
«адача 9. Ќайти тепловой эффект реакции ZnS(т) + 3/2O2 (г) = ZnO(т) + SO2 (г)
при температуре 900о—, если зависимости теплоемкостей реагентов от температуры таковы:
—р (ZnS(т)) = 54Ј103 + 4,96Ј“ Ц 8,12Ј108Ј“-2 ƒж/(кмольЈ );
—р (Znќ(т))= 47,6Ј103 + 4,8Ј“ Ц 8,25Ј108Ј“-2 ƒж/(кмольЈ );
—р (O2(г)) = 31,5Ј103 + 3,39Ј“ Ц 3,77Ј108Ј“-2 ƒж/(кмольЈ );
—р (Sќ2(г)) = 71,5Ј103 + 10,73Ј“ Ц 12,72Ј108Ј“-2 ƒж/(кмольЈ ).
—тандартные теплоты образовани€ веществ из элементов следующие:
Δ fЌ 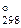 (ZnS(т)) = -203Ј106 ƒж/кмоль;
(ZnS(т)) = -203Ј106 ƒж/кмоль;
Δ fЌ 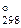 (Znќ(т)) = -348Ј106 ƒж/кмоль;
(Znќ(т)) = -348Ј106 ƒж/кмоль;
Δ fЌ 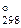 (Sќ2(г)) = -297Ј106 ƒж/кмоль.
(Sќ2(г)) = -297Ј106 ƒж/кмоль.
«адача 10. Ќайдите значение теплового эффекта реакции
Fe2O3 (т) + 2Al(т) = 2Fe(т) + Al2O3 (т)
при 650о—, использу€ следующие данные по теплоемкости:
|
|
|
—р(Al)= 0,745 + 44,98Ј10-5Ј“ (ƒж/(гЈград);
—р(Al2O3)= 1,082 + 17,4Ј10-5Ј“ Ц 30,4Ј103ЈT-2 (ƒж/(гЈград);
—р(Fe)= 0,31 + 48Ј10-5Ј“ (ƒж/(гЈград);
—р(Fe2O3)= 0,647 + 42,1Ј10-5Ј“ Ц 11,1Ј103ЈT-2 (ƒж/(гЈград).
—тандартный тепловой эффект реакции равен -1698Ј106 ƒж/кмоль.
«адача 11. ќпределить теплоту реакции —а—2 + 2Ќ2ќ = —а(ќЌ)2 + —2Ќ2,
если теплоты образовани€ —а—2, Ќ2ќ, —а(ќЌ)2 и —2Ќ2 соответственно равны 15000, -68317, 235800 и -54190 кал/моль. ќтвет приведите в кƒж/моль.
«адача 12. Ќайти теплоту образовани€ аммиака на основании следующих данных:
2Ќ2 + ќ2 = 2Ќ2ќ + 571,4 кƒж
4NH3 + 3O2 = 6H2O + 2N2 + 1529,5 кƒж
«адача 13.. –ассчитайте энтальпию, энтропию и свободную Їнергию √иббса реакции окислени€ глюкозы —6Ќ12ќ6 (т) + 6ќ2(г) = 6—ќ2(г) + 6Ќ2ќ (ж)
ѕо значени€м стандартных энтальпий образовани€ и энтропий:
| ќ2 | —ќ2 | Ќ2ќ | —6Ќ12ќ6 | |
Δ Ќ 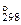 , кƒж/моль , кƒж/моль
| -393,5 | -285,8 | -1273,0 | |
Δ S 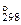 , ƒж/моль×K , ƒж/моль×K
| 205,0 | 213,7 | 70,1 | 212,13 |
ΔG 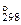 , кƒж/мольK , кƒж/мольK
| -394,4 | 237,3 | -919,5 |
«адача 14. »спользу€ инкрементную схему, рассчитайте значение изобарной теплоемкости изо-бутилацетата при 293 .
«адача 15. ѕри растворении 8 г хлорида аммони€ в 29 г воды температура понизилась на 2о. ¬ычислите теплоту растворени€ NH4Cl в воде, принима€ удельную теплоемкость полученного раствора, равной теплоемкости воды 4,1870 ƒж/(гЈ ).
«адача 16. –ассчитайте изменение внутренней энергии гели€ (одноатомный идеальный газ) при изобарном расширении от 5 до 10 л под давлением 196 кѕа.
«адача 17. »спользу€ первый закон термодинамики и определение теплоемкости, найдите разность изобарной и изохорной теплоемкостей дл€ произвольной термодинамической системы.
«адача 18. ќдин моль ксенона, наход€щийс€ при 25о— и 2 атм, расшир€етс€ адиабатически: а) обратимо до 1 атм, б) против давлени€ 1 атм. акой будет конечна€ температура в каждом случае?
«адача 19. “емпературна€ зависимость константы равновеси€ реакции гидрировани€ этилбензола до этилциклогексана —6Ќ5 + —2Ќ5 + 3Ќ2 ↔ —6Ќ11 Ц —2Ќ5
выражаетс€ следующим эмпирическим уравнением
lgK– = 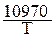 Ц 35,54
Ц 35,54
Ќайдите тепловой эффект реакции при температуре 600 .
«адача 20. онстанта равновеси€ р реакции дегидрировани€ этанола
—2Ќ5ќЌ(г) = —Ќ3—Ќќ(г) + Ќ2 (г)
при 378 равна 6,4Ј10-9. “еплоты сгорани€ этанола и уксусного альдегида соответственно равны (в кƒж/моль): -1412 и 1196. “еплота образовани€ воды равна -287 кƒж/моль. ѕользу€сь этими данными, рассчитайте константу р при 403 .
«адача 21. ќдин моль вод€ных паров обратимо и изотермически сконденсировали в жидкость при 100о—. –ассчитайте работу, теплоту, изменение внутренней энергии и энтальпии в этом процессе. ”дельна€ теплота испарени€ воды при 100о— равна 2260 ƒжЈг-1.
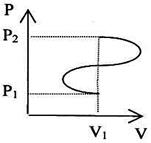 «адача 22. Ќайдите изменение энтропии идеального газа в процессе от точки 1 до точки 2.
«адача 22. Ќайдите изменение энтропии идеального газа в процессе от точки 1 до точки 2.
«адача 23. аково изменение энтропии при изобарическом нагревании 1 кмоль бромида кали€ от 300 до 400 ?
“еплоемкость твердого бромида кали€ выражаетс€
уравнением Cр (KBr) = 40,4Ј10-2 + 12,8Ј10-3ЈT (ƒж/(гЈград).
«адача 24. Ќайдите изменение энтропии при смешении 200 г воды, вз€той при температуре 320 , и 150 г льда, вз€того при температуре 263 . “еплоемкость воды равна 4,187 ƒж/(гЈград), льда - 1,88 ƒж/(гЈград), а удельна€ теплота плавлени€ льда - 335 ƒж/г.
|
|
|
«адача 25. Ќайдите изменение энтропии при изотермическом смешении 1 кмоль азота с 1 кмоль кислорода, вз€том при том же давлении. ѕрин€ть, что оба газа подчин€ютс€ уравнению состо€ни€ идеальных газов.
«адача 26. Ќормальна€ температура замерзани€ жидкости ј равна “о. ∆идкость переохлаждена до температуры “1 (“1<“о). Ќайти изменение энтропии при перекристаллизации переохлажденной жидкости, прин€в, что нормальна€ теплота плавлени€ вещества ј равна Δ H о, а теплоемкости жидкости и твердого вещества равны —ж и —т и не завис€т от температуры.
«адача 27. Ќайдите изменение энтропии газа и окружающей среды, если n молей идеального газа расшир€ютс€ изотермически от объема V1 до объема V2:
а) обратимо; б) против внешнего давлени€ p.
«адача 28. –ассчитайте изменение энтропии при нагревании 0,7 моль моноклинной серы от 25 до 200о— при давлении 1 атм. ћольна€ теплоемкость серы равна:
Cp (S(тв)) = 23,64 ƒжЈмоль-1Ј -1,
Cp (S(ж)) = 35,73 + 1,17Ј10-3Ј“ ƒжЈмоль-1Ј -1.
“емпература плавлени€ моноклинной серы 119о—, удельна€ теплота плавлени€ 45,2 ƒжЈг-1.
«адача 29. –ассчитайте изменение энтропии 1000 г воды в результате ее замерзани€ при -5о—. “еплота плавлени€ льда при 0о— равна 6008 ƒжЈмоль-1. “еплоемкости льда и воды равны 34,7 и 75,3 ƒжЈмоль-1Ј -1, соответственно. ќбъ€сните, почему энтропи€ при замерзании уменьшаетс€, хот€ процесс Ц самопроизвольный.
«адача 30. ќпределите количество теплоты, выдел€ющейс€ при гашении 100 кг извести водой при 25о—, если известны стандартные теплоты образовани€ веществ, участвующих в химической реакции:
Δ Ќ 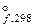 (CaO(к))= -635,1 кƒж/моль;
(CaO(к))= -635,1 кƒж/моль;
Δ Ќ 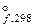 (Ќ2ќ(ж)) = -285,84 кƒж/моль;
(Ќ2ќ(ж)) = -285,84 кƒж/моль;
Δ Ќ 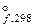 (Ca(OЌ)2 (к)) = -986,2 кƒж/моль.
(Ca(OЌ)2 (к)) = -986,2 кƒж/моль.
«адача 31. ќпределите стандартную теплоту образовани€ этилового спирта, если теплоты сгорани€ углерода, водорода и этилового спирта равны соответственно: -393,51; -285,84; -1366,9 кƒж/моль.
«адача 32. –ассчитайте Δ Ќ 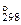 и Δ U системы: 2Cl2 + 2H2O(г) = 4HCl(г) + O2
и Δ U системы: 2Cl2 + 2H2O(г) = 4HCl(г) + O2
если Δ Ќ 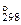 (Ќ2ќ(г)) = Ц 241,84 кƒж/моль, Δ Ќ
(Ќ2ќ(г)) = Ц 241,84 кƒж/моль, Δ Ќ 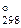 (H—l(г)) = 92,3 кƒж/моль.
(H—l(г)) = 92,3 кƒж/моль.
«адача 33. ќпределите тепловой эффект реакции синтеза акриловой кислоты при 298 : —Ќ ≡ —Ќ(г) + —ќ(г) + Ќ2ќ(ж) → —Ќ2 = —Ќ Ц —ќќЌ(ж) , если известны стандартные теплоты сгорани€ веществ, участвующих в химической реакции:
Δ Ќ 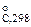 (—Ќ ≡ —Ќ(г)) = -1299,63 кƒж/моль;
(—Ќ ≡ —Ќ(г)) = -1299,63 кƒж/моль;
Δ Ќ 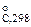 (—ќ(г)) = -282,5 кƒж/моль;
(—ќ(г)) = -282,5 кƒж/моль;
Δ Ќ 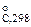 (—Ќ2 = —Ќ Ц —ќќЌ(ж)) = -1370 кƒж/моль.
(—Ќ2 = —Ќ Ц —ќќЌ(ж)) = -1370 кƒж/моль.
«адача 34. ќпределите изменение внутренней энергии при испарении 250 г воды при 20о—, допуска€, что пары воды подчин€ютс€ законам идеальных газов. ќбъемом жидкости по сравнению с объемом пара можно пренебречь. ”дельна€ теплота парообразовани€ воды 2451 ƒж/г.
«адача 35. ”дельна€ теплота плавлени€ свинца 23040 ƒж/кг. “емпература плавлени€ свинца 327,4о—. Ќайдите изменение энтропии при плавлении 250 г свинца.
«адача 36. ¬ каком направлении пойдет реакци€, если реагирующие вещества вз€ты в стандартных услови€х
SiO2 (к) + 2NaOH(р) = Na2SiO3 (к) + H2O(ж)
Δ G 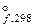 (SiO2 (к)) = -803,75 кƒж/моль;
(SiO2 (к)) = -803,75 кƒж/моль;
Δ G 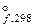 (NaOH(р)) = -419,5 кƒж/моль;
(NaOH(р)) = -419,5 кƒж/моль;
Δ G 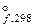 (Na2SiO3 (к)) = -1427,8 кƒж/моль;
(Na2SiO3 (к)) = -1427,8 кƒж/моль;
Δ G 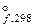 (Ќ2ќ(ж)) = - 237,5 кƒж/моль?
(Ќ2ќ(ж)) = - 237,5 кƒж/моль?
«адача 37. ќпределите изменение энтропии в стандартных услови€х дл€ следующей химической реакции: 2—(графит) + 3Ќ2 (г) → —2Ќ6 (г).
Ёнтропии веществ, участвующих в химической реакции:
Δ S 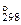 (C(графит)) = 5,74 ƒж/(мольЈ );
(C(графит)) = 5,74 ƒж/(мольЈ );
Δ S 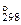 (Ќ2 (г)) = 130,6 ƒж/(мольЈ );
(Ќ2 (г)) = 130,6 ƒж/(мольЈ );
Δ S 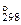 (C2Ќ6 (г)) = 229,5 ƒж/(мольЈ ).
(C2Ќ6 (г)) = 229,5 ƒж/(мольЈ ).
«адача 38. ¬ычислите стандартное изменение энергии √иббса дл€ химической реакции NH3 (г) + H—l(г) = NH4Cl(к) по значени€м стандартных теплот образовани€ и энтропий веществ, участвующих в реакции.
¬ещество NH3 H—l NH4Cl
Δ Ќ 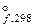 , кƒж/моль - 46,19 - 92,3 - 315,39
, кƒж/моль - 46,19 - 92,3 - 315,39
S 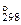 , ƒж/(мольЈ ) 192,5 186,7 94,56
, ƒж/(мольЈ ) 192,5 186,7 94,56
«адача 39. ƒл€ реакции —2Ќ5ќЌ(ж) + —Ќ3—ќќЌ(ж) ↔ —Ќ3—ќќ—2Ќ5 (ж) + Ќ2ќ(ж)
при 298 с = 4. Ќайдите выход эфира (в граммах), если вз€ты 100 г спирта и 20 г уксусной кислоты.
|
|
|
«адача 40. ќпределить теплоту сгорани€ этилена C2H4+3O2=2CO2+2H2O(ж)+ Q
исход€ из следующих данных:
2—гр + 2Ќ2 = —2Ќ4 Ц 62,01 кƒж/моль (а) —гр + ќ2 = —ќ2 + 393,9 кƒж/моль (б) Ќ2 + 1/2ќ2 = Ќ2ќ(ж) + 284,9 кƒж/моль (в)
«адача 41. ќпределить теплоту образовани€ ацетилена по энерги€м св€зей отдельных его атомов: 2—гр + Ќ2 = —2Ќ2 + Q обр. Ёнерги€ св€зи — Ц Ќ составл€ет 358,2, — ≡ — 536 кƒж, Ќ Ц Ќ 430 кƒж.
—равнить полученный результат с табличным значением.
«адача 42. –ассчитать тепловой эффект сгорани€ диэтилового эфира (—2Ќ5)2ќ по энерги€м разрыва св€зей при 298 . “еплота испарени€ эфира q  = 26,2 кƒж/моль, а теплота испарени€ воды q
= 26,2 кƒж/моль, а теплота испарени€ воды q 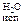 = 44,0 кƒж/моль. Ёнерги€ св€зи ≈ —=ќ = 702,9; ≈ ќ-Ќ = 460; ≈ —-Ќ = 358,2; ≈ —-— = 262,8; ≈ —-ќ = 374; ≈ ќ≡ќ = 490,4 кƒж.
= 44,0 кƒж/моль. Ёнерги€ св€зи ≈ —=ќ = 702,9; ≈ ќ-Ќ = 460; ≈ —-Ќ = 358,2; ≈ —-— = 262,8; ≈ —-ќ = 374; ≈ ќ≡ќ = 490,4 кƒж.
«адача 43. ¬ычислить интегральную теплоту растворени€ хлорида аммони€, если при растворении 1,473 г этой соли в 528,5 г воды температура понизилась на 0,174о—. ћассова€ теплоемкость полученного раствора 4,109 ƒж/(гЈ ). “еплоемкость калориметра 181,4 ƒж/ .
«адача 44. акое количество теплоты выделитс€ при растворении 200 г моногидрата H2SO4 в 350 см3 воды?
«адача 45. “епловой эффект сгорани€ —ќ до —ќ2 при 25о— равен 283 кƒж/моль. ќпределить зависимость теплового эффекта этой реакции от температуры и его значение при 2000 . “емпературные зависимости мол€рных теплоемкостей веществ, участвующих в реакции, выражаетс€ следующими уравнени€ми:
дл€ —ќ2 —υ = 21,39 + 0,02975Ј“ Ц 0,000007793Ј“2 ƒж/моль,
дл€ —ќ и ќ2 —υ = 18,92 + 0,00149Ј“ ƒж/моль.
«адача 46. ѕодсчитать тепловой эффект реакции при 600о—, протекающей по уравнению —ќ + Ќ2ќ(пар) = —ќ2 + Ќ2, использу€ температурные зависимости теплоемкостей реагирующих веществ:
—р (—ќ) = 28,41 + 4,10Ј10-3Ј“ Ц 0,46Ј105Ј“-2 ƒж/(мольЈ ),
—р (Ќ2ќ) = 30,00 + 10,71Ј10-3Ј“ Ц 0,33Ј105Ј“-2 ƒж/(мольЈ ),
—р (—ќ2) = 44,14 + 9,04Ј10-3Ј“ Ц 8,53Ј105Ј“-2 ƒж/(мольЈ ),
—р (Ќ2) = 27,28 + 3,26Ј10-3Ј“ Ц 0,502Ј105Ј“-2 ƒж/(мольЈ ).
ΔЌо—ќ = 110,5; ΔЌоЌ2=0; ΔЌо—ќ2 = 393,51; ΔЌоЌ2ќ = 241,84 кƒж/моль.
«адача 47. –ассчитать тепловой эффект реакции, протекающей по уравнению
—ќ + Ќ2ќ(пар) = —ќ2 + Ќ2 по энтальпи€м образовани€ веществ. ΔЌо (—ќ)= 110,5, ΔЌо (Ќ2ќ пар) = 241,84, ΔЌо (—ќ2)=393,51 кƒж/моль.
«адача 48. ѕри охлаждении 12 л кислорода от 200 до -40о— одновременно повышаетс€ давление от 105 до 6Ј106 ѕа. –ассчитать изменение энтропии, если —р(ќ2) = 29,2 ƒж/(мольЈ ). (—читать кислород идеальным газом).
«адача 49. ќпределить изменение энтропии ΔS при нагревании 30 г лед€ной уксусной кислоты от температуры плавлени€ до 60о—. “емпература плавлени€ уксусной кислоты 16,6о—, теплота плавлени€ 194 ƒж/г. ћассова€ теплоемкость уксусной кислоты в пределах 0 Ц 80о— выражаетс€ формулой с = 1,96 + 0,0039Ј t ƒж/(гЈ ).
«адача 50. ќпределить изменение энтропии и изобарно-изотермического потенциала при стандартных услови€х дл€ реакции Fe3O4 + CO = 3FeO + CO2,
и решить вопрос о возможности самопроизвольного протекани€ ее при указанных услови€х:
Δ G о (CO2) = -394,89 кƒж/моль; Δ G о (CO) = -137,4 кƒж/моль;
Δ G о (FeO) = -246,0 кƒж/моль; Δ G о (Fe3O4) = -1010 кƒж/моль.
«адача 51. ¬ычислить стандартное изменение изобарного потенциала Δ G о дл€ реакции —2Ќ2 + 5/2ќ2 = 2—ќ2 + Ќ2ќ(ж) + Δ G о
Δ Ќ0 (—ќ2) = -393,51; Δ Ќ0 (Ќ2ќж) = - 285,84; Δ Ќ0 (—2Ќ2) = 226,75 кƒж/моль
Δ S0 (—ќ2) = 213,6; Δ S0 (Ќ2ќж) = 69,96; Δ S0 (—2Ќ2) = 200,8; Δ S0 (ќ2) = 205,03 ƒж/мольЈ .
II. ‘ј«ќ¬џ≈ –ј¬Ќќ¬≈—»я
«адача 52. ƒиметилформамид (ƒћ‘ј) используетс€ в качестве растворител€ в производстве барбамила и других барбитуровых препаратов. ƒл€ выбора оптимальных условий проведени€ регенерации были определены значени€ давлени€ насыщенного пара ƒћ‘ј при различных температурах:
|
|
|
| “, | |||||||
| р, гѕа | 189,1 | 270,5 | 380,1 | 525,1 | 956,9 | 1010,8 | 1265,4 |
–ассчитайте среднее значение теплоты испарени€ ƒћ‘ј в изученном интервале температур.
«адача 53. –ассчитайте ∆ Ќ исп и температуру кипени€ диэтилового эфира при нормальном атмосферном давлении, использу€ температурную зависимость давлени€ насыщенного пара:
| t, о— | -10 | ||||
| р, гѕа |
«адача 54. ѕо экспериментально определенным при различных температурах значени€м давлени€ насыщенного пара хлороформа, примен€емого дл€ наркоза, дл€ растирани€, в качестве консерванта и др., вычислите среднее значение мол€рной теплоты испарени€ —ЌCl3:
| t, о— | -10 | ||||
| р, гѕа |
«адача 55. –езультаты изучени€ температурной зависимости насыщенного пара бутен-2-ал€-1, используемого в синтезе витаминов ј и ≈, приведены в таблице:
| “, | 290,03 | 310,72 | 314,51 | 321,92 | 329,21 | 346,07 | 350,05 |
| р, гѕа | 3,613 | 8,826 | 11,519 | 15,452 | 19,732 | 39,410 | 45,129 |
¬ычислите значени€ мол€рной теплоты испарени€ бутен-2-ал€-1 дл€ данного температурного интервала.
«адача 56. ќпределить теплоту испарени€ ртути, если упругость пара при 330о— равна 459,74 мм рт. ст. и температура кипени€ ртути при атмосферном давлении равна 357о—.
«адача 57. ќпределить температуру кипени€ воды при давлении 2 атм., если теплота испарени€ воды при 100о— равна 538,9 кал/г.
«адача 58. “емпература плавлени€ йода равна 112,9о—. Ќайти теплоту возгонки йода при температуре плавлени€, если возрастание упругости пара вблизи температуры плавлени€ при увеличении температуры на 1о— равно 4,35 мм рт.ст. на градус, а упругость пара твердого йода при температуре плавлени€ равна 88,88 мм рт.ст.
«адача 59. ѕод каким давлением вода будет кипеть при 97о—? ”дельна€ теплота испарени€ воды l = 538,9 кал/г.
 «адача 60. ќпределить понижение температуры плавлени€ кадми€ при давлении 100 атм; удельна€ теплота плавлени€ кадми€ l пл. = 13,7 кал/г, температура плавлени€ при 1 атм равна 320,9о—, удельный вес твердого кадми€ 8,366 г/см3; удельный вес жидкого металла 7,989 г/см3.
«адача 60. ќпределить понижение температуры плавлени€ кадми€ при давлении 100 атм; удельна€ теплота плавлени€ кадми€ l пл. = 13,7 кал/г, температура плавлени€ при 1 атм равна 320,9о—, удельный вес твердого кадми€ 8,366 г/см3; удельный вес жидкого металла 7,989 г/см3.
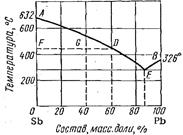
«адача 61. ¬оспользовавшись диаграммой состо€ни€ SbЦPb (рис.1), определить количество выкристалли- зовавшейс€ сурьмы при охлаждении до 430о— 3 кг жидкого сплава с содержанием 40 масс. доли, % свинца.
|
«адача 63. “емпература кипени€ ртути под нормальным атмосферным давлением 357о—. “еплота парообразовани€ 283,2 ƒж/г. ќпределить изменение давлени€ пара ртути при изменении температуры на 1о— вблизи температуры кипени€ ртути под нормальным атмосферным давлением.
«адача 64. ”дельна€ теплота плавлени€ нафталина, при его нормальной “пл. 79,9о— равна 149,25 ƒж/г. –азность удельных объемов в жидком и твердом состо€ни€х при температуре плавлени€ (Δυ) 0,146 см3/г. ќпределить изменение температуры плавлени€ нафталина при увеличении давлени€ в 100 раз по сравнению с нормальным атмосферным давлением (101325 ѕа).
III. ’»ћ»„≈— ќ≈ –ј¬Ќќ¬≈—»≈
«адача 65. ≈сли в закрытом сосуде нагреть до 445о— 8 молей I2 и 5,3 мол€ H2, то при достижении равновеси€ образуетс€ 9,5 мол€ HI. Ќайти выход HI, если исходить из 8 молей I2 и 3 молей H2.
«адача 66. онстанта равновеси€ реакции образовани€ HCl при некоторой температуре равна с = 1. ќпределить состав (в мольных процентах) равновесной реакционной смеси, полученной из 5 л H2 и 2 л Cl2.
«адача 67. ѕри некоторой температуре и давлении 1 атм. степень диссоциации HI на H2 и I2 равна 22 %. ќпределить значение р и с.
«адача 68. јмпулу с 4,6 г охлажденного жидкого азотноватого ангидрида N2O4 поместили в сосуд емкостью 5,7 л. »з сосуда откачали воздух. «атем с помощью бойка разбивают ампулу с N2O4 и сосуд, содержащий N2O4, нагревают до 50о—. ¬ результате испарени€ и его диссоциации в сосуде создаетс€ давление, равное 0,4586 атм. ¬ычислить степень диссоциации N2O4 и константу равновеси€ с дл€ реакции: N2O4 Ђ2NO2.
«адача 69. »сходна€ смесь содержит 0,4 мол€ H2 и 0,6 мол€ CO2. ¬ычислить степень превращени€ CO2 в CO при 1000 , если р = 1,37.
|
|
|
«адача 70. —месь, состо€щую из 7% SO2, 11% O2 и 82% N2, под давлением в 1 атм. в присутствии катализатора нагрели до 1000 . ѕосле установлени€ равновеси€ SO2 оказалось 4,7%. Ќайти степень окислени€ SO2, константы равновеси€ р и с реакции 2SO2 + O2 Ђ2SO3.
«адача 71. ¬ычислить константу равновеси€ реакции восстановлении FeO окисью углерода при 1000 и давлении 1 атм., если установлено, что равновесна€ смесь газов содержала 39% CO2.
«адача 72. ƒл€ реакции —(кокс.) + Ќ2ќ Ђ—ќ + Ќ2 при температуре 500о— и давлении в 1 атм. константа химического равновеси€ р = 0,02138. ¬ычислить долю —ќ в равновесной смеси.
«адача 73. ƒл€ реакции CO + H2O ЂCO2 + H2 константа равновеси€ при 1000 р,1000 = 1,36 и при 1200 р,1200 = 0,68. ќпределить тепловой эффект реакции на данном температурном интервале и константу равновеси€ при 1100 .
«адача 74. ќпределить тепловой эффект реакции диссоциации известн€ка
CaCO3 ЂCaO + CO2 ,
если упругость диссоциации при 800о— равна 201,3 мм рт. ст., а при 900о— равна 992 мм рт. ст.
«адача 75. Ќайти константу равновеси€ реакции синтеза NH3, протекающей согласно уравнению 1/2N2 + 3/2H2 ЂNH3, при 700 , зна€, что при 25о— константа равновеси€ р,298 = 832, тепловой эффект Q р,298 = 11040 кал/моль и, исход€ из следующих значений мольных теплоемкостей газов
—р (N2) = 6,66 + 1,02Ј10-3Ј“;
—р (H2) = 6,99 Ц 0,2Ј10-3Ј“ + 0,48Ј10-6Ј“2;
—р (NH3) = 7,12 + 6,09Ј10-3Ј“ Ц 0,398Ј105Ј“-2.
«адача 76. ѕри нагревании водорода и йода в закрытом сосуде до 444о— обратимо протекает реакци€ по уравнению H2 + I2 ↔ 2HI. –авновесна€ смесь при этой температуре содержит 5,64 моль ЌI, 0,12 моль I2 и 5,28 моль Ќ2. ¬ычислить константу равновеси€ указанной реакции и исходные концентрации водорода и йода.
«адача 77. онстанта равновеси€ реакции
—Ќ3—ќќЌ + —2Ќ5ќЌ ↔ —Ќ3—ќќ—2Ќ5 + Ќ2ќ
при некоторой температуре равна 4. ќпределить состав реакционной смеси при равновесии, если в реакцию введены 1 моль кислоты и 2 моль спирта.
«адача 78. ќпределить состав равновесной смеси в паровоздушном генераторе при 986о—, если константа равновеси€ реакции, протекающей в генераторе
Ќ2ќ(пар) + —ќ ↔ Ќ2 + —ќ2 равна 0,623.
Ќачальный состав смеси (об. доли, %): —ќ2 12; Ќ2 1; —ќ 10,0 и Ќ2ќ(пар) 15 (остальное приходитс€ на азот, который в реакции не участвует).
«адача 79. онстанта равновеси€ р реакции синтеза аммиака N2+3H2↔2NH3 при 350о— равна 2,32Ј10-13. ¬ычислить сдл€ этого процесса при той же температуре.
«адача 80. ќпределить состав смеси в момент равновеси€ дл€ реакции
—+ќ2↔ —ќ2, если при 1300о— константа равновеси€ этой реакции равна 0,289.
«адача 81. ¬ывести уравнение дл€ константы равновеси€ реакции
2—ќ + 2Ќ2 ↔ —Ќ4 + —ќ2 + Q,
если 2CO ↔ C + CO2 + Q1 (а) C + 2H2 ↔ CH4 + Q2 (б)
«адача 82. онстанта равновеси€ р реакции I2↔2I- при T1 = 677о— равна 1,149Ј102, а при T2 = 777о— равна 7,413Ј102. ¬ычислить константу равновеси€ указанной реакции при 727о—.
«адача 83. ”пругость диссоциации карбоната кальци€ при 881о— 80380 ѕа, а при 891 Ц 91177 ѕа. –ассчитать, при какой температуре упругость диссоциации карбоната кальци€ будет равна 101325 ѕа.
IV. –ј—“¬ќ–џ
«адача 84. онстанта диссоциации циановой кислоты согласно уравнению
HCNO ↔ H+ + CNOЦ
при 291 равна 1,2Ј10-4. ќпределите концентрацию анионов CNOЦ в растворе, содержащем 0,6 кмоль/м3 циановой кислоты.
«адача 85. онстанта диссоциации о -иодбензойной кислоты при 298 равна 1,4Ј10-3: C6H4COOH ↔ H+ + IC6H4COOЦ. акова степень диссоциации о -йодбензойной кислоты в растворе с концентрацией 0,5 кгЈмоль/м3?
«адача 86. «начение р д диссоциации бромида этиламмони€ в нитрометане равно 3,62. ќпределите изотонический коэффициент дл€ раствора этиламмони€ бромида C2H5NH3Br в нитрометане, если концентраци€ равна 0,05 кмоль/м3 (р д представл€ет собой вз€тый со знаком минус дес€тичный логарифм константы диссоциации, т. е. р д = Ц lg д).
«адача 87. –ассчитайте массу сульфата натри€, которую необходимо растворить в 100 г воды, чтобы температура кипени€ повысилась на 1,340о—? ажуща€с€ степень диссоциации соли в этом растворе 44,9 %.
«адача 88. ћол€льность нитрата кальци€ Ca(NO3)2 равна 0,2 моль/кг, среднеионный коэффициент активности при этой мол€льности равен 0,426. ќпределите среднюю ионную мол€льность, среднюю ионную активность и мольную активность.
«адача 89. –ассчитайте активность электролита а и среднюю ионную активность а ± в 0,1 ћ растворе CaCl2 при 25о—, если средний ионный коэффициент активности γ±= 0,518.
«адача 90. –ассчитайте ионную силу раствора, содержащего 0,08 кмоль сульфата натри€ Na2SO4 и 0,02 кмоль сульфата хрома Cr2(SO4)3 в 1000 кг воды.
«адача 91. ќпределите средний коэффициент активности 0,5%-го раствора хлорида бари€ BaCl2.
«адача 92. –астворимость AgCl в воде при 25о— равна 1,274Ј10-5 мольЈкг-1. –ассчитайте: а) стандартную энергию √иббса дл€ реакции AgCl(тв)→Ag+(aq)+ClЦ(aq); б) растворимость в 0,020 мольЈкг-1 водном растворе K2SO4.
«адача 93. –ассчитайте эбуллиоскопическую посто€нную дл€ воды, если известно, что при нормальной температуре кипени€ (373 ) ее удельна€ теплота испарени€ равна 2,464 кƒж/моль.
«адача 94. –ассчитайте удельную теплоту испарени€ анилина, нормальна€ температура которого 458 , если экспериментально найденна€ дл€ него эбуллиоскопическа€ посто€нна€ равна 3,69.
«адача 95. ¬ычислите осмотическое давление раствора, содержащего в 1,4 л 63 г глюкозы —6Ќ12ќ6 при 0о—.
«адача 96. –ассчитайте молекул€рную массу неэлектролита, если в 5 л раствора содержитс€ 2,5 г неэлектролита. ќсмотического давление этого раствора равно 0,23Ј105 ѕа при 20о—.
«адача 97. ¬ычислите давление пара над раствором, содержащим 34,23 г сахара —12Ќ22ќ11, в 45,05 г воды при 65о—, если давление паров воды при этой температуре равно 2,5Ј104 ѕа.
«адача 98. –ассчитайте молекул€рную массу неэлектролита, если 28,5 г этого вещества, растворенного в 785 г воды, вызывает понижение давлени€ пара воды над раствором на 52,37 ѕа при 40о—. ƒавление вод€ного пара при этой температуре равно 7375,9 ѕа.
«адача 99. ќпределите температуру кипени€ и замерзани€ раствора, содержащего 1 г нитробензола —6Ќ5Nќ2 в 10 г бензола. Ёбуллиоскопическа€ и криоскопическа€ константы бензола соответственно равны 2,57 и 5,1о—. “емпература кипени€ чистого бензола 80,2о—, температура замерзани€ Ц 5,4о—.
«адача 100. –аствор камфары массой 0,552 г в 17 г эфира кипит при температуре на 0,461о— выше, чем чистый эфир. Ёбуллиоскопическа€ константа эфира 2,16о—. ќпределите молекул€рную массу камфары.
«адача 101. ¬ычислите криоскопическую константу воды, если водный раствор этилового спирта (ω = 11,3 %) замерзает при Ц 5о—.
«адача 102. ќсмотическое давление 0,1 н. ZnSO4 при 0о— равно 1,59Ј105 ѕа. ¬ычислите изотонический коэффициент этого раствора.
«адача 103. –аствор, содержащий 8 г NaOH в 1000 г H2O, кипит при 100,184о—. ќпределите изотонический коэффициент (дл€ воды э = 0,516).
«адача 104. ƒавление вод€ного пара над раствором 24,8 г KCl в 100 г H2O при 100о— равно 9,14Ј104 ѕа. ¬ычислите изотонический коэффициент, если давление вод€ного пара при этой температуре равно 1,0133Ј105 ѕа.
«адача 105. »зотонический коэффициент 0,2 н. раствора нитрата кальци€ равен 2,48. ¬ычислите кажущуюс€ степень диссоциации этого электролита.
«адача 106. –ассчитайте кажущуюс€ степень электролитической диссоциации LiCl в 0,1 н. растворе соли, если раствор изотоничен с 0,19 ћ раствором сахара —12Ќ22ќ11 при 0о—.
«адача 107. ƒавление пара водного раствора NaNO3 (ω = 8 %) равно 2268,8 ѕа при 20о—. ƒавление паров воды при этой температуре равно 2337,8 ѕа. Ќайдите кажущуюс€ степень диссоциации нитрата натри€ в этом растворе.
«адача 108. Ќайдите степень диссоциации сероводородной кислоты по первой ступени в 0,1 ћ растворе, если константа диссоциации дл€ этой ступени равна 1,1Ј10-7.
«адача 109. ќпределите концентрацию ионов ќЌЦ в 0,01 ћ растворе гидроксида аммони€, если д = 1,77Ј10-5.
«адача 110. ак изменитс€ концентраци€ ионов Ќ+ в 0,1 ћ растворе синильной кислоты, если в 1 л раствора добавить 0,1 моль NaCN, кажуща€с€ степень диссоциации которого 85%? онстанта диссоциации синильной кислоты равна 4,9Ј10-10.
«адача 111. –ассчитайте активную концентрацию хлорида кальци€ в водном растворе, содержащем 0,925 г CaCl2 в 500 г воды.
«адача 112. ќсмотическое давление 0,1 н. ZnSO4 при 0о— равно 1,59Ј105 ѕа. ќпределить кажущуюс€ степень диссоциации соли в данном растворе.
«адача 113. ќпределить концентрацию раствора глюкозы, если раствор этого вещества при 18о— изотоничен с раствором, содержащим 0,5 моль/л хлорида кальци€. ажуща€с€ степень диссоциации CaCl2 в растворе при указанной температуре составл€ет 65,4 %.
«адача 114. ƒавление пара чистого ацетона при 20о— 23940 ѕа. ƒавление пара раствора камфары в ацетоне, содержащего 5 г камфары на 200 г ацетона при той же температуре, равно 23710 ѕа. ќпределить молекул€рную массу камфары, растворенной в ацетоне.
«адача 115. ƒавление пара раствора, содержащего 5 г едкого натра в 180 г воды, при 100о— 99000 ѕа. ¬ычислить кажущуюс€ степень диссоциации едкого натра в данном растворе.
«адача 116. ќпределить атмосферное давление, если 0,1 ћ Nа—l кипит при 99,8о—? ажуща€с€ степень диссоциации 0,1 ћ NaCl 84,4%. ƒавление насыщенного пара чистой воды при 99,8о— 100600 ѕа. ѕлотность раствора ρ = 1.
«адача 117. ¬ыразить концентрацию водного раствора глицерина —3Ќ8ќ3 в масс. дол€, если он замерзает при Ц 0,52о—.
«адача 118. ѕри какой примерно температуре будет замерзать водный раствор этилового спирта концентрации 0,4 (40%) масс. доли —2Ќ5ќЌ.
«адача 119. –аствор, содержащий 1,70 г хлорида цинка в 250 г воды, замерзает при Ц 0,23о—. ќпределить кажущуюс€ степень диссоциации хлорида цинка в этом растворе.
«адача 120. ќпределить температуру кипени€ раствора едкого кали, содержащего в 100 г воды 14 г ќЌ. ажуща€с€ степень диссоциации ќЌ в растворе равна 60%.
«адача 121. ¬одный раствор, содержащий нелетучее растворенное вещество Ц неэлектролит, замерзает при Ц 3,5о—. ќпределить температуру кипени€ раствора и давление пара раствора при 25о—. ƒавление пара чистой воды при 25о— 3167,2 ѕа.
ЁЋ≈ “–ќ’»ћ»я
«адача 122. –ассчитайте эквивалентные электропроводности при предельном разведении раствора хлорида цези€ и определите числа переноса вход€щих в его состав ионов, если предельные эквивалентные электропроводности при 25о— ионов цези€ и хлора равны 7,72 и 7,685 ќм-1×кг×экв-1Јм2.
«адача 123. ѕредельна€ эквивалентна€ электропроводность синильной кислоты HCN при 25о— равна 42,8 ќм-1ЈкгЈэкв-1Јм2, а константа диссоциации - 7,9Ј10-10.„ему равна удельна€ электропроводность раствора HCN, концентраци€ которого равна 0,2 кгЈэкв/м3?
«адача 124. ”дельна€ электропроводность 0,135 мольЈл-1 раствора пропионовой кислоты —2Ќ5—ќќЌ равна 4,79Ј10-2 —мЈм-1. –ассчитайте эквивалентную электропроводность раствора, константу диссоциации и рЌ раствора, если предельные подвижности Ќ+ и —2Ќ5—ќќЦ равны 349,8 —мЈсм2Јмоль-1 и 37,2 —мЈсм2Јмоль-1 , соответственно.
«адача 125. ”дельна€ электропроводность насыщенного раствора ¬а—ќ3 в воде при 18о— равна 25,475Ј10-4 —мЈм-1. ”дельна€ электропроводность воды 4,5Ј10-5 —мЈм-1. ѕодвижность ионов ¬а2+ и —ќ 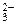 при 18о— равны соответственно 55 и 66 —мЈсм2ЈгЈэкв-1. –ассчитайте растворимость ¬а—ќ3 в воде при 18о— в мольЈл-1. —чита€ соль полностью диссоциированной, а подвижности ионов равными подвижност€м при бесконечном разбавлении.
при 18о— равны соответственно 55 и 66 —мЈсм2ЈгЈэкв-1. –ассчитайте растворимость ¬а—ќ3 в воде при 18о— в мольЈл-1. —чита€ соль полностью диссоциированной, а подвижности ионов равными подвижност€м при бесконечном разбавлении.
«адача 126. ”дельна€ электропроводность 5%-го раствора Mg(NO3)2 при 18о— равна 4,38 —мЈм-1, а его плотность Ц 1,038 гЈсм-3. –ассчитайте эквивалентную электропроводность раствора и кажущуюс€ степень диссоциации соли в растворе. ѕодвижности ионов Mg2+ и NO 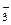 при 18о— равны 44,6 и 62,6 —мЈсм2ЈгЈэкв-1 , соответственно.
при 18о— равны 44,6 и 62,6 —мЈсм2ЈгЈэкв-1 , соответственно.
«адача 127. ¬одные растворы нитрата серебра широко примен€ютс€ наружно дл€ смазывани€ кожи и дл€ прижигани€. ”дельна€ электрическа€ проводимость раствора AgNO3 с массовой долей 10% (ρ = 1,088 г/мл) при 18о— равна 4,76 см/м. –ассчитайте мол€рную электрическую проводимость этого раствора.
«адача 128. ¬ таблице приведены результаты измерени€ скорости движени€ молекул сывороточного альбумина быка (—јЅ) в электрическом поле при различных значени€х рЌ раствора (отрицательные значени€ скорости соответствуют изменению направлени€ движени€ частиц под действием пол€). »спользу€ эти данные, определите изоэлектрическую точку —јЅ.
| рЌ | 4,2 | 4,56 | 5,2 | 5,65 | 6,3 |
| υ, мкмЈс-1 | 0,5 | 0,18 | - 0,25 | - 0,60 | - 0,95 |
«адача 129. ќпределите электродный потенциал цинка, опущенного в раствор его соли с концентрацией ионов 0,001 моль/л. —тандартный электродный потенциал цинка φ0 Zn0/Zn2+ = - 0,76 ¬.
«адача 130. »сход€ из значений стандартных электродных потенциалов и Δ G 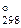 , укажите, можно ли, в гальваническом элементе осуществить следующую реакцию: Fe + Cd2+ ↔ Fe2+ + Cd (φ0 Cd2+/Cd0 = 0,4¬; φ0 Fe 2+/ Fe0 = - 0,44 ¬).
, укажите, можно ли, в гальваническом элементе осуществить следующую реакцию: Fe + Cd2+ ↔ Fe2+ + Cd (φ0 Cd2+/Cd0 = 0,4¬; φ0 Fe 2+/ Fe0 = - 0,44 ¬).
«адача 131. ќпределите Ёƒ— гальванической цепи:
(Ц) Fe | 0,1 ћ FeSO4 || 0,01 н. NaOH | H2, Pt (+)
—тепени электролитической диссоциации FeSO4 и NaOH соответственно равны 60 и 100% (φ0 Fe2+/ Fe0 = - 0,44 ¬; φ0 2Ќ+/Ќ2 = 0).
«адача 132. ¬ычислите Ёƒ— газоводородной цепи
(Ц) Pt, H2 | 0,008 н. NaOH || 0,006 н. HCl | H2, Pt (+),
если коэффициенты активности ионов равны: f 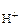 = 0,944; f
= 0,944; f 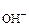 = 0,916. —тепени диссоциации приведенных электролитов прин€ть равной 10%.
= 0,916. —тепени диссоциации приведенных электролитов прин€ть равной 10%.
«адача 133. √альванический элемент, содержит медный (φ 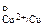 = 0,337 ¬) и кадмиевый (φ
= 0,337 ¬) и кадмиевый (φ 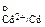 = -0,403 ¬) электроды. ѕриведите уравнение, выражающее зависимость Ёƒ— от активности ионов, условную запись гальванического элемента и уравнение протекающей в гальваническом элементе реакции.
= -0,403 ¬) электроды. ѕриведите уравнение, выражающее зависимость Ёƒ— от активности ионов, условную запись гальванического элемента и уравнение протекающей в гальваническом элементе реакции.
«адача 134. ѕриведите схемы гальванических элементов, в которых обратимо и изотермически можно проводить следующие реакции:
а) H2 + ½O2 = H2O;
б) 5SO32Ц + 2MnO4Ц + 6H+ = 5SO42Ц + 2Mn2+ + 3H2O.
«адача 135. ѕриведите схему гальванического элемента, в котором при температуре 1200 можно провести реакцию Ag + ½Cl2 = AgCl.
«адача 136. ѕроводима€ в гальваническом элементе реакци€
Pb(т) + 2AgI(т) = PbI2 (т) + 2Ag(т)
при 298 характеризуетс€ следующими данными:
≈ = 0,21069 ¬; d E /d T = Ц 1,38Ј10-4 ¬/град.
¬ычислите стандартное изменение энергии √иббса, энтальпии и энтропии.
«адача 137. –ассчитайте произведение растворимости хлорида и иодида талли€ (LTlCl и LTlI), если известны стандартные потенциалы, на которых протекают следующие процессы (при 25о—):
1) Tl+ + ē = Tl; φ 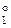 = + 0,799 ¬
= + 0,799 ¬
2) TlCl + ē = Tl + ClЦ; φ 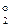 = -0,557 ¬
= -0,557 ¬
3) TlI + ē = Tl + IЦ. φ 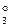 = -0,753 ¬
= -0,753 ¬
«адача 138. —тандартные электродные потенциалы пар RibO/Rib (окисленна€ и восстановленна€ форма рибофлавина) и CH3COOH/CH3CHO (уксусна€ кислота - ацетальдегид) при 25о— равны, соответственно, -0,21 ¬ и -0,60 ¬. –ассчитайте константу равновеси€ реакции восстановлени€ рибофлавина ацетальдегидом при температуре 25о— в нейтральном растворе. ак отразитс€ на величине Ёƒ— соответствующего гальванического элемента изменение кислотности раствора?
«адача 139. Δ Ќ реакции Pb + Hg2Cl2 = PbCl2 + 2Hg, протекающей в гальваническом элементе, равно -94,2 кƒжЈмоль-1 при 298,2 . Ёƒ— этого элемента возрастает на 1,45Ј10-4 ¬ при повышении температуры на 1 . –ассчитайте Ёƒ— элемента и Δ S при 298,2 .
«адача 140. ÷инковый электрод погружен в 0,1н раствор сульфата цинка при температуре 25о—. ¬ычислить, насколько изменитс€ электродный потенциал цинка при изменении концентрации до 0,01 н., если средние коэффициенты активности дл€ указанных концентраций соответственно равны 0,20 и 0,48.
«адача 141. Ёƒ— цепи (Ц) Ni | NiSO4 || H2SO4 | H2, Pt (+) ≈ = 0,309 ¬. ќпределите активность ионов никел€, если a 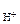 = 1, φ
= 1, φ 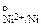 = 0,25 ¬.
= 0,25 ¬.
«адача 142. ќпределить какие преимущественно ионы железа (Fe2+ или Fe3+) образуютс€ при анодном растворении железа, если φ 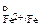 =-0,441 ¬, а φ
=-0,441 ¬, а φ 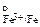 =-0,036 ¬ при температуре 25о—.
=-0,036 ¬ при температуре 25о—.
«адача 143. Ќайдите произведение растворимости AgCl (при T= 25о—), если Ёƒ— гальванической цепи
(Ц) Ag(т) | AgCl(т), KCl || NH4NO3, AgNO3 | Ag (+)
(насыщ.) m = 0,1
E = 0,448 B, γClЦ = 0,769; γAg+ = 0,72 и потенциал φ  = 0,799 ¬.
= 0,799 ¬.
«адача 144. ѕоказать, что потенциал электрода сурьмы Ц оксид сурьмы представл€ет простую функцию от рЌ раствора.
«адача 145. ќпределить стандартный потенциал Pb2+/Pb относительно нормального каломельного электрода, если известно, что Ёƒ— гальванической цепи
(Ц) Pb | Pb(NO3)2 | NH4NO3, | Ќормальный каломельный (+)
m = 0,01 (насыщ.) электрод
≈ = 0,469, T = 25оC, φ нормального каломельного электрода = 0,282 ¬.
«адача 146. Ёлектрокинетический потенциал частиц гидрозол€ 50 м¬. ѕриложенна€ внешн€€ Ёƒ— 240 ¬, а рассто€ние между электродами 40 см. ¬ычислить электрофоретическую скорость частиц зол€, если форма их цилиндрическа€. ¬€зкость воды 0,001ѕаЈс, а диэлектрическа€ проницаемость среды 81.
VI. ’»ћ»„≈— јя »Ќ≈“» ј
«адача 147. онстанта скорости реакции дегидрировани€ метиламина
CH3NH2 → HCN + 2H2
равна 5,0Ј10-3 с-1 при 913 . «а какое врем€ концентраци€ метиламина уменьшитс€ в 2 раза? „ему равно среднее врем€ жизни молекулы метиламина?
«адача 148. –еакци€ самоокислени€ Ц самовосстановлени€ ионов гипобромида с образованием броматов и бромидов в щелочной среде 3BrOЦ → BrO3Ц + 2BrЦ
описываетс€ кинетическим уравнением реакции 2-го пор€дка с константой скорости, равной 9,3Ј10-4 м3(кмольЈс). »сходна€ концентраци€ гипобромида равна 0,1 кмоль/м3. «а какое врем€ прореагирует 30% исходного количества гипобромид-ионов?
«адача 149. –азложение оксида азота (V) (в газовой фазе) протекает согласно схеме: 2N2O5 → 2N2O4 + O2 и описываетс€ кинетическим уравнением реакции первого пор€дка. онстанта скорости этой реакции при 273 равна 7,9Ј10-7 с-1. »сходное давление оксида азота (V) равно 25 тор. ¬ычислите, за какое врем€ давление в смеси газообразных соединений повыситс€ до 28 тор.
«адача 150. ѕри взаимодействии брома и этилового спирта по реакции
C2H5OH + Br2 → CH3COH + 2HBr
были получены следующие данные:
| τ, мин | ||
| — 1, н | 0,00814 | 0,00610 |
| — 2, н | 0,00424 | 0,00314 |
ќпределить пор€док реакции.
«адача 151. »з приведенных ниже данных дл€ реакции превращени€ цианата аммони€ в мочевину, протекающей в водном растворе по схеме
NH4CNO → (NH2)2CO.
ќпределить пор€док реакции:
| а, гЈмоль/л | 0,05 | 0,10 | 0,20 |
| τ½, ч | 37,03 | 19,5 | 9,45 |
«адача 152. ѕри разложении перекиси водорода в водном растворе в присутствии платиновой фольги были получены следующие данные:
| τ, мин | |||
V 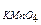 мл (объем раствора KMnO
необходимый дл€ титровани€ раствора Ќ2ќ2). мл (объем раствора KMnO
необходимый дл€ титровани€ раствора Ќ2ќ2).
| 22,8 | 13,8 | 8,25 |
ќпределить пор€док реакции.
«адача 153. ѕротекание реакции HBrO3 + 5HBr → 3Br2 + 3H2O изучалось с помощью титровани€ тиосульфатом. ¬ первом случае на титрование пошло V1 = 54,33 мл, во втором случае V2 = 77,0 мл 0,1 н. раствора тиосульфата. ¬ обоих случа€х исходные концентрации уменьшились на 1/3 начальной величины, причем в первом случае врем€, затраченное на завершение указанной стадии, τ1 = 5 мин, во втором τ2 = 50 мин. ќпределить пор€док реакции.
«адача 154. ѕри 50о— и давлении 0,344 атм степень диссоциации N2O4 на NO2 равна 63 %. ќпределить значени€ р и с.
«адача 155. –ассчитайте энергию активации реакции термического разложени€ лекарственного вещества (“1 = 29 ), если температурный коэффициент скорости реакции составл€ет 3.
«адача 156. ќпределить константу скорости реакции между SO2 и NO2, при T = 208,2о—. Ёнерги€ активации ≈ = 26500 кал/моль.
«адача 157. ѕользу€сь уравнением lg k = ј - 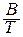 ,определить зависимость температурного коэффициента реакции γ от температурыγ =
,определить зависимость температурного коэффициента реакции γ от температурыγ = 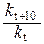
«адача 158. –ассчитайте энергию активации химической реакции и предэкспоненциональный множитель, если константы скорости реакции при 273 и 280 соответственно равны 4,04Ј10-5 и 7,72Ј10-5 с-1.
«адача 159. ƒл€ реакции разложени€ оксида азота 2NO ↔ N2 + O2 известны значени€ константы скорости: при “1 = 1620 , k 1 = 0,0180 гЈмоль/(лЈсекЈатм2); при
“2 = 1525 , k 2 = 0,0030 гЈмоль/(лЈсекЈатм2).
¬оспользовавшись уравнени€ми теории абсолютных скоростей реакций, рассчитать:
а) Δ H * и Δ S * при усредненной температуре 1572 ;
б) Δ H * и Δ S * при 2500 дл€ пр€мой и обратной реакций;
в) константы скорости пр€мой и обратной реакции при “ = 2500 ,
если прин€ть, что дл€ N2 Δ — p* = Ц 1,0 кал/(мольЈград).
оэффициенты летучести, фактор сжимаемости и трансмиссионный коэффициент считать равным 1; Δ H 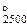 = - 43327 кал/гЈмоль; Δ S
= - 43327 кал/гЈмоль; Δ S 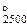 = - 6,009 э. е.
= - 6,009 э. е.
«адача 160. ќпределить энергию активации реакции
Cu + (NH4)2S2O8 → CuSO4 + (NH4)2SO4 ,
если известно, что дл€ различных температур значени€ констант скорости реакции следующие:
| t, о— | |||
| kЈ103 | 9,6 | 18,16 | 39,96 |
«адача 161. ¬ присутствии ионов CNЦ бензальдегид превращаетс€ в бензоин
C6H5CH=O + C6H5CH=O → C6H5CHOHCOC6H5.
ќпределить энергию активации этого превращени€, если известны следующие данные:
| t, о— | 49,9 | ||
| k | 0,026 | 0,048 | 0,089 |
«адача 162. –еакци€ разложени€ перекиси водорода в водном растворе протекает как реакци€ первого пор€дка. ѕериод половины превращени€ Ќ2ќ2при заданных услови€х равен 15,86 мин. ќпределить, какое врем€ потребуетс€ дл€ разложени€ (при тех же услови€х) 99% Ќ2ќ2.
«адача 163. “ростниковый сахар в присутствии ионов водорода подвергаетс€ гидролизу с образованием глюкозы и фруктозы (реакци€ инверсий тростникового сахара):
—12Ќ22ќ11 + Ќ2ќ 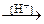 → —6Ќ12ќ6 + —6Ќ12ќ6
→ —6Ќ12ќ6 + —6Ќ12ќ6
–аствор тростникового сахара вращает плоскость пол€ризации пол€ризованного луча вправо, а смесь глюкозы и фруктозы Ц влево. ”гол вращени€ пропорционален концентрации растворенных веществ. ѕри 22о— в присутствии 1н и большого избытка воды изменение угла вращени€ плоскости пол€ризации пол€ризованного луча раствором сахара характеризовалось следующими данными:
| ¬рем€, мин | ∞ | |||
| ”гол вращени€, град | 37,0 | 30,0 | 20,7 | -12,4 |
ќпределить: 1) среднее значение константы скорости реакции инверсии сахара при 22о—; 2) количество сахара (масс. доли, %), вступившего в реакцию через 5 часов от начала опыта; 3) угол вращени€ к этому моменту времени.
«адача 164. онстанта скорости омылени€ этилового эфира уксусной кислоты едким натром при 10о— 2,38. ќпределить врем€ (мин), необходимое дл€ омылени€ 90% уксусноэтилового эфира, если смешать при 10о— 1 л 0,05 н. раствора эфира с:
1) 1 л 0,05 н. NaOH; 2) 1 л 0,1 н. NaOH.
«адача 165. »спользу€ приближенное правило ¬ант-√оффа, вычислить, на сколько нужно повысить температуру, чтобы скорость реакции возросла в 80 раз? “емпературный коэффициент скорости прин€ть равным 3.
«адача 166. ¬оспользовавшись приближенным правилом ¬ант-√оффа, вычислить, при какой температуре некотора€ реакци€ закончитс€ за 25 мин, если при 20о— на это требуетс€ 2 часа. “емпературный коэффициент скорости реакции 3.
«адача 167. ƒл€ одной из реакций были определены две константы скорости: при 443о— 0,00670 и при 497о— 0,06857. ќпределить константу скорости этой же реакции при 508о—.






