ќсновные пон€ти€ и законы химии. ’имическа€ св€зь. —троение и свойства вещества
1. акие вещества называют простыми? —ложными? »з приведенных веществ выберите простые: —ќ, ќ3, —аќ, , Ќ2, Ќ2ќ.
2. акие вещества называют оксидами? ислотами? ќсновани€ми? —ол€ми?
3. »з приведенных оксидов Ц SO2, CaO, ZnO, Cr2O3, CrO, P2O5, CO2, Cl2O3, Al2O3 Ц выберите основные, кислотные и амфотерные.
4. акие соли относ€т к кислым, основным, средним, двойным, смешанным, комплексным?
5. Ќазовите следующие соединени€: ZnOHCl, KHSO3, NaAl(SO4)2. какому классу соединений они относ€тс€?
6. „то называют основностью кислоты?
7. »з приведенных гидроксидов выберите амфотерные: Fe(OH)2, KOH, Al(OH)3, Ca(OH)2, Fe(OH)3, Pb(OH)2.
8. „то называют схемой реакции? ”равнением реакции?
9. ак называют числа, сто€щие в уравнении реакции? „то они показывают?
10. ак перейти от схемы реакции к уравнению?
11. — какими веществами вступают во взаимодействие основные оксиды? јмфотерные оксиды? ислотные оксиды?
12. — какими веществами вступают во взаимодействие основани€?
13. — какими веществами вступают во взаимодействие кислоты?
14. — какими веществами вступают во взаимодействие соли?
15. ќпределите массовые доли элементов в азотной кислоте HNO3.
16. акие металлы взаимодействуют с щелочами?
17. акие металлы взаимодействуют с растворами серной и сол€ной кислот?
18. акие продукты образуютс€ при взаимодействии металлов с азотной кислотой различной концентрации?
19. акие реакции называют реакци€ми разложени€? —оединени€? «амещени€? ќкислительно-восстановительными?
20. —оставьте уравнени€ реакций: CrCl3 + NaOH→; CrCl3 + 2NaOH→; CrCl3 + 3NaOH→; CrCl3 + NaOH(избыток)→.
21. —оставьте уравнени€ реакций: Al + KOH →; Al + KOH + Ќ2ќ →.
22. „то называют атомом? ’имическим элементом? ћолекулой?
23. акие элементы относ€т к металлам? Ќеметаллам? ѕочему?
24. „то называют химической формулой вещества? „то она показывает?
25. „то называют структурной формулой вещества? „то она показывает?
26. „то называют количеством вещества?
27. „то называют молем? „то он показывает? акое количество структурных единиц содержитс€ в моле вещества?
28. акие массы элементов указаны в ѕериодической системе?
29. „то называют относительными атомной, молекул€рной массами? ак их определ€ют? аковы их единицы измерени€?
30. „то называют мол€рной массой вещества? ак ее определ€ют? акова ее единица измерени€?
31. акие услови€ называют нормальными услови€ми?
32. акой объем занимает 1 моль газа при н.у.? 5 моль газа при н.у.?
33. »з чего состоит атом?
34. »з чего состоит €дро атома? акой зар€д имеет €дро атома? „ем определ€етс€ зар€д €дра атома? „ем определ€етс€ масса €дра атома?
35. „то называют массовым числом?
36. „то называют энергетическим уровнем? —колько электронов расположено на отдельном энергетическом уровне?
37. „то называют атомной орбиталью? ак ее изображают?
38. „то характеризует главное квантовое число? ќрбитальное квантовое число? ћагнитное квантовое число? —пиновое квантовое число?
|
|
|
39. акова св€зь между главным и орбитальным квантовыми числами? ћежду орбитальным и магнитным квантовыми числами?
40. ак называют электроны с  = 0?
= 0?  = 1?
= 1?  = 2?
= 2?  = 3? —колько орбиталей соответствует каждому из данных состо€ний электрона?
= 3? —колько орбиталей соответствует каждому из данных состо€ний электрона?
41. акое состо€ние атома называют основным? ¬озбужденным?
42. —колько электронов может располагатьс€ на одной атомной орбитали? „ем они отличаютс€?
43. ќктет электронов на внешней оболочке имеет Ќе+, S-2, C+4, O, F-, Cl+5.
44. —колько и какие подуровни могут располагатьс€ на первом энергетическом уровне? Ќа втором? Ќа третьем? Ќа четвертом?
45. —формулируйте принцип наименьшей энергии, правила лечковского, принцип ѕаули, правило ’унда, периодический закон.
46. „то периодически измен€етс€ дл€ атомов элементов?
47. „то общего у элементов одной подгруппы? ќдного периода?
48. „ем отличаютс€ элементы главных подгрупп от элементов побочных подгрупп?
49. —оставьте электронные формулы ионов —r+3, —а+2, N-3. акое количество неспаренных электронов имеют указанные ионы?
50. акую энергию называют энергией ионизации? —родством к электрону? Ёлектроотрицательностью?
51. ак измен€ютс€ радиусы атомов и ионов в группе и в периоде ѕериодической системе ƒ.». ћенделеева?
52. ак измен€ютс€ электроотрицательности атомов в группе и в периоде ѕериодической системе ƒ.». ћенделеева?
53. ак измен€ютс€ металлические свойства элементов и свойства их соединений в группе и в периоде ѕериодической системе ƒ.». ћенделеева?
54. —оставьте формулы высших оксидов алюмини€, фосфора, брома, марганца.
55. ак определ€етс€ количество протонов, нейтронов и электронов в атоме?
56. —колько протонов, нейтронов и электронов содержитс€ в атоме цинка?
57. —колько электронов и протонов содержитс€ в ионах —r+3, —а+2, N-3?
58. —формулируйте закон сохранени€ массы? „то остаетс€ посто€нным при протекании любой химической реакции?
59. акой параметр остаетс€ посто€нным в изобарных химических реакци€х?
60. —формулируйте закон посто€нства состава. ƒл€ веществ какой структуры он справедлив?
61. —формулируйте закон јвогадро и следстви€ из него.
62. ≈сли плотность газа по азоту составл€ет 0,8, то какова мол€рна€ масса газа?
63. ¬ случае изменени€ каких внешних параметров измен€етс€ мол€рный объем газа?
64. —формулируйте объединенный газовый закон.
65. ƒл€ равных объемов разных газов при одних и тех же услови€х массы газов будут равны?
66. —формулируйте закон ƒальтона. ≈сли общее давление смеси азота и водорода составл€ет 6 атм., а объемное содержание водорода 20%, то каковы парциальные давлени€ компонентов?
67. «апишите уравнение ћенделеева- лапейрона (состо€ни€ идеального газа).
68. акую массу имеет смесь газов, состо€ща€ из 11,2 л азота и 11,2 л фтора (н.у.)?
69. „то называют химическим эквивалентом? ћол€рной массой эквивалента?
70. ак определ€ют мол€рные массы эквивалентов простых и сложных веществ?
71. ќпределите мол€рные массы эквивалентов следующих веществ: ќ2, Ќ2ќ, —а—l2, —а(ќЌ)2, Ќ2S.
72. ќпределите эквивалент Bi(OH)3 в реакции Bi(OH)3 + HNO3 = Bi(OH)2(NO3) + H2O.
73. —формулируйте закон эквивалентов.
74. „то называют мол€рным объемов эквивалента вещества? ак его определ€ют?
75. —формулируйте закон объемных отношений.
76. акой объем кислорода потребуетс€ на окисление 8 м3 водорода (н.у.) по реакции 2H2 + O2 ↔ 2H2O?
|
|
|
77. акой объем хлороводорода образуетс€ при взаимодействии 15 л хлора и 20 л водорода?
78. „то понимают под химической св€зью? ”кажите характеристики химической св€зи.
79. „то €вл€етс€ мерой прочности химической св€зи?
80. „то вли€ет на распределение электронной плотности?
81. „то определ€ет форму молекулы?
82. „то называют валентностью?
83. ќпределите валентности азота в следующих соединени€х: N2, NH3, N2H4, NH4Cl, NaNO3.
84. „то называют степенью окислени€?
85. акую св€зь называют ковалентной?
86. ”кажите свойства ковалентной св€зи.
87. ак измен€етс€ пол€рность св€зи в р€ду I, Br, Cl, F?
88. ћолекулы какого вещества непол€рны: кислород, хлороводород, аммиак, уксусна€ кислота.
89. „то понимают под гибридизацией валентных орбиталей?
90. ќпределите типы гибридизации центральных атомов в следующих веществах: фторид берилли€, хлорид алюмини€, метан.
91. ак вли€ет тип гибридизации на пространственное строение молекул?
92. акую св€зь называют ионной? ѕод воздействием каких сил она возникает?
93. акую св€зь называют металлической?
94. акими свойствами обладают вещества с металлическим типом химической св€зи?
95. „ему равно максимальное число  -св€зей, которое может образовыватьс€ между двум€ атомами в молекуле?
-св€зей, которое может образовыватьс€ между двум€ атомами в молекуле?
96. ак определ€етс€ абсолютна€ электроотрицательность атома элемента?
97. –асположите элементы в пор€дке возрастани€ их электроотрицательности: Fe, C, Ag, H, Cl.
98. „то называют дипольным моментом св€зи? ак его рассчитывают?
99. акими особенност€ми обладают вещества с атомной кристаллической решеткой? — молекул€рной кристаллической решеткой?
100. акую св€зь называют водородной? ќт чего зависит ее прочность? ћежду молекулами каких неорганических веществ она возникает?
“ермодинамика и кинетика химических реакций
1. „то изучает термодинамика?
2. „то называют термодинамической системой? акие виды систем существуют?
3. „то называют параметрами состо€ни€? акие параметры называют интенсивными, экстенсивными? Ќазовите основные параметры химической системы.
4. „то называют процессом? —амопроизвольным процессом? ÷иклом? –авновесным процессом? Ќеравновесным процессом? ќбратимым процессом?
5. „то называют фазой? √омогенной, гетерогенной системой?
6. „то называют функцией состо€ни€?
7. „то характеризует внутренн€€ энерги€ U? ќт чего зависит внутренн€€ энерги€?
8. „то называют теплотой Q? акие реакции €вл€ютс€ экзотермическими, эндотермическими? ак при их протекании измен€етс€ теплота и энтальпи€?
9. „то называют работой p∆V?
10. —формулируйте первый закон термодинамики. «апишите его математически.
11. —формулируйте первый закон термодинамики дл€ изотермического, изохорного и изобарного процессов.
12. „то называют энтальпией?
13. „то называют тепловым эффектом реакции? ќт чего зависит тепловой эффект реакции?
14. акое уравнение называют термодинамическим? “ермохимическим?
15. акие услови€ называют стандартными?
16. „то называют энтальпией реакции? —тандартной энтальпией реакции?
17. „то называют энтальпией образовани€ вещества? —тандартной энтальпией образовани€ вещества?
18. акое состо€ние вещества €вл€етс€ стандартным? „ему равна энтальпи€ образовани€ простого вещества в стандартном состо€нии?
19. Ёнтальпи€ образовани€ H2SO3 по величине равна тепловому эффекту реакции: H2(г) + S(тв) + 1,5ќ2(г) 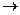 H2SO3(ж); H2(г) + Sќ2(г) + 0,5ќ2(г)
H2SO3(ж); H2(г) + Sќ2(г) + 0,5ќ2(г) 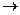 H2SO3(ж); H2ќ(г) + Sќ2(г)
H2SO3(ж); H2ќ(г) + Sќ2(г) 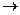 H2SO3(ж); 2H(г) + S(тв) + 3ќ(г)
H2SO3(ж); 2H(г) + S(тв) + 3ќ(г) 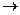 H2SO3(ж).
H2SO3(ж).
20. ѕри взаимодействии 1 мол€ водорода и 1 мол€ брома выделилось 500 кƒж тепла. „ему равна ∆Ќобр, HBr?
21. ѕри образовании 5 молей вещества јх¬у поглотилось 500 кƒж тепла. „ему равна ∆Ќобр этого вещества?
22. „то называют энтальпией сгорани€? —тандартной энтальпией сгорани€? “еплотворной способностью?
23. —формулируйте закон √есса, первое и второе следстви€ из него.
24. акое выражение применимо дл€ расчета ∆Ќр реакции 2ј + 3¬  2— по следствию закона √есса:
2— по следствию закона √есса:
|
|
|
∆Ќр = 2∆Ќобр, — + 2∆Ќобр, ј + 3∆Ќобр, ¬ ; ∆Ќр = 2∆Ќобр, — Ц (2∆Ќобр, ј + 3∆Ќобр, ¬);
∆Ќр = 2∆Ќобр, ј + 3∆Ќобр, ¬ Ц2∆Ќобр, —; ∆Ќр = Ц 2∆Ќобр, — Ц (2∆Ќобр, ј + 3∆Ќобр, ¬)?
25. —тандартна€ энтальпи€ сгорани€ (∆Ќ0сгор) метанола —Ќ4ќ(ж) (ћ = 32 г/моль) равна -726,6 кƒж/моль. акое количество тепла выделитс€ при сгорании 2,5 кг вещества?
26. ¬ каком случае стандартна€ энтальпи€ сгорани€ одного вещества равна стандартной энтальпии образовани€ другого вещества?
27. ƒл€ каких веществ стандартна€ энтальпи€ сгорани€ равна нулю: —ќ, —ќ2, Ќ2, ќ2?
28. ƒл€ реакции 2Cl2(г) + 2H2O(ж)  4HCl(г) + ќ2(г) рассчитайте стандартную энтальпию (кƒж), если известны стандартные энтальпии образовани€ веществ:
4HCl(г) + ќ2(г) рассчитайте стандартную энтальпию (кƒж), если известны стандартные энтальпии образовани€ веществ:
| ¬ещество | HCl | ќ2 | Cl2 | H2O |
∆Ќ  , кƒж/моль , кƒж/моль
| -92,31 | -285,83 |
29. ∆Ќ  = -1410,97 кƒж/моль; ∆Ќ
= -1410,97 кƒж/моль; ∆Ќ  = -2877,13 кƒж/моль. акое количество теплоты выделитс€ при совместном сжигании 2 моль этилена и 4 моль бутана?
= -2877,13 кƒж/моль. акое количество теплоты выделитс€ при совместном сжигании 2 моль этилена и 4 моль бутана?
30. ∆Ќ  = -1410,97 кƒж/моль; ∆Ќ
= -1410,97 кƒж/моль; ∆Ќ  = -2877,13 кƒж/моль. акое количество теплоты выделитс€ при сжигании 0,7 кг газовой смеси, состо€щей из 20% этилена и 80% бутана?
= -2877,13 кƒж/моль. акое количество теплоты выделитс€ при сжигании 0,7 кг газовой смеси, состо€щей из 20% этилена и 80% бутана?
31. —тандартна€ энтальпи€ реакции MgCO3(тв) → MgO(тв) + —ќ2(г) равна 101,6 кƒж; стандартные энтальпии образовани€ MgO(тв) и —ќ2(г): -601,0 и -393,5 кƒж/моль соответственно. „ему равна стандартна€ энтальпи€ образовани€ карбоната магни€ Mg—O3?
32. „то называют термодинамической веро€тностью системы? „то называют энтропией? ак энтропи€ выражаетс€ через термодинамическую веро€тность?
33. —формулируйте второй закон термодинамики.
34. „то называют стандартной энтропией вещества?
35. —формулируйте третье начало термодинамики (постулат ѕланка).
36. „то называют энтропией реакции? —тандартной энтропией реакции?
37. акое выражение применимо дл€ расчета ∆Sр реакции CH4 + CO2  2CO + 2H2:
2CO + 2H2:
∆Sр = S  + S
+ S  + S
+ S  + S
+ S  ; ∆Sр = S
; ∆Sр = S  + S
+ S  + 2S
+ 2S  + 2S
+ 2S  ;
;
∆Sр = 2S  + 2S
+ 2S  Ц S
Ц S  + S
+ S  ; ∆Sр = 2S
; ∆Sр = 2S  + 2S
+ 2S  Ц S
Ц S  Ц S
Ц S  ?
?
38. ƒл€ реакции 2Cl2(u) + 2H2O(ж)  4HCl(г) + ќ2(г) рассчитайте стандартную энтропию (ƒж/ ), если известны стандартные энтропии образовани€ веществ:
4HCl(г) + ќ2(г) рассчитайте стандартную энтропию (ƒж/ ), если известны стандартные энтропии образовани€ веществ:
| ¬ещество | HCl | ќ2 | Cl2 | H2O |
| S0, ƒж/мольЈ | 186,79 | 205,04 | 222,98 | 70,08 |
39. „то называют свободной энергией √иббса? акова ее св€зь с другими термодинамическими функци€ми?
40. ак по знаку энергии √иббса реакции определ€ют направление реакции?
41. ѕри каких температурах возможна реакци€, если ∆H<0, ∆S>0; ∆H<0, ∆S<0; ∆H>0, ∆S>0; ∆H>0, ∆S<0.
42. ак определ€ют равновесную температуру процесса?
43. „то называют энерги€ √иббса реакции ∆Gр? —тандартной энергией √иббса реакции?
44. акое выражение применимо дл€ расчета ∆Gр реакции 4NH3(г) + 5O2(г)  4NO(г) + 6H2ќ(ж)
4NO(г) + 6H2ќ(ж)
∆Gр = ∆G4  + ∆G5
+ ∆G5 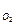 + ∆G4
+ ∆G4  + ∆G6
+ ∆G6 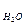 ; ∆Gр = ∆G
; ∆Gр = ∆G  + ∆G
+ ∆G 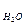 + ∆G
+ ∆G  + ∆G
+ ∆G 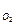 ;
;
∆Gр = 4∆G  + 5∆G
+ 5∆G 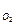 - 4∆G
- 4∆G  - 6∆G
- 6∆G 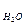 ; ∆Gр = 4∆G
; ∆Gр = 4∆G  + 6∆G
+ 6∆G 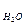 - 4∆G
- 4∆G  - 5∆G
- 5∆G 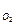 ?
?
45. ƒл€ реакции HNO3(ж) + HNO2(ж)  2NO2(г) + H2O(ж) рассчитайте стандартную энергию √иббса (кƒж), если известны стандартные энергии √иббса образовани€ веществ:
2NO2(г) + H2O(ж) рассчитайте стандартную энергию √иббса (кƒж), если известны стандартные энергии √иббса образовани€ веществ:
| ¬ещество | NO2 | H2O | HNO3 | HNO2 |
| ∆G0, кƒж/моль | 51,5 | -237,2 | -80,8 | -55,6 |
46. ƒл€ реакции Fe(тв) + Al2O3(тв) → Al(тв) + Fe2O3(тв) определите равновесную температуру и возможность протекани€ процесса при 1250—, если ∆Ќ  = 853,8 кƒж/моль; ∆S
= 853,8 кƒж/моль; ∆S  = 37,68 ƒж/мольЈK.
= 37,68 ƒж/мольЈK.
|
|
|
47. „то понимают под скоростью химической реакции?
48. —формулируйте закон действующих масс.
49. «а 40 с в результате двух реакций Zn + 2HCl = ZnCl2 + H2 (1) и Zn + 2HBr = ZnBr2 + H2 (2) образовалось по 8 г хлорида и бромида цинка. —равните скорости реакций.
50. ≈сли в реакции 3Fe(NO3)2(р-р) + 4HNO3 = 3Fe(NO3)3(р-р) + NO(г) + 2H2O(ж) концентрацию Fe(NO3)2 увеличить в 7 раза, а концентрацию HNO3 в 4 раза, то как изменитс€ скорость реакции?
51. —оставьте кинетическое уравнение реакции Sb2S3(тв) + 3Ќ2(г)  2Sb(тв) + 3H2S(г).
2Sb(тв) + 3H2S(г).
52. ак определ€етс€ скорость многостадийной реакции?
53. ак изменитс€ скорость пр€мой реакции —ќ(г) + 3Ќ2(г)  —Ќ4(г) + Ќ2ќ(г) при увеличении давлени€ системы в 3 раза?
—Ќ4(г) + Ќ2ќ(г) при увеличении давлени€ системы в 3 раза?
54. „то называют константой скорость? ќт чего она зависит?
55. „то называют энергией активации? ќт чего она зависит?
56. онстанта скорости некоторой реакции при температуре 310 равна 4,6∙10-5 лЈмоль-1Јс-1, а при температуре 330 6,8∙10-5 лЈмоль-1Јс-1. „ему равна энерги€ активации равна?
57. Ёнерги€ активации некоторой реакции равна 250 кƒж/моль. ак изменитс€ константа скорости при изменении температуры проведени€ реакции от 320 до 340 ?
58. «апишите уравнение јррениуса и правило ¬ант-√оффа.
59. Ёнерги€ активации реакции (1) равна 150 кƒж/моль, энерги€ активации реакции (2) равна 176 кƒж/моль. —равните константы скорости k1 и k2.
60. „ем объ€снить повышение скорости реакции с повышением температуры?
61. „то называют температурным коэффициентом реакции?
62. „ему равен температурный коэффициент реакции, если константа скорости некоторой реакции при 283 и 308 составл€ет соответственно 1,77 и 7,56 лЈмоль-1Јс-1?
63. ѕри температуре 350 реакци€ закончилась за 3 с, а при температуре 330 Ц за 28 с. «а какое врем€ она закончитс€ при температуре 310 ?
64. ак вли€ет энерги€ активации на температурный коэффициент реакции?
65. „то называют катализатором? »нгибитором? ѕромотором? аталитическим €дом?
66. „то называют химическим равновесием? ƒо каких пор в системе сохран€етс€ равновесное состо€ние?
67. ак св€заны скорости пр€мой и обратной реакций в момент равновеси€?
68. „то называют константой равновеси€? ќт чего она зависит?
69. ¬ыразите константу равновеси€ реакций 2NO + O2 ↔ 2NO2; Sb2S3(тв) + 3Ќ2 ↔ 2Sb(тв) + 3Ќ2S(г).
70. ѕри некоторой температуре константа равновеси€ реакции N2O4 ↔ 2NO2 равна 0,16. ¬ исходном состо€нии NO2 не было, а равновесна€ концентраци€ NO2 составила 0,08 моль/л. „ему будут равны равновесна€ и исходна€ концентраци€ N2O4?
71. —формулируйте принцип Ће Ўателье. ак вли€ют на смешение равновеси€ изменение температуры, концентрации, общего давлени€?
72. ’имическое динамическое равновесие в системе установилось при 1000 и давлении 1 атм., когда в результате реакции Fe(тв) + —ќ2(г) ↔ FeO(тв) + —ќ(г) парциальное давление углекислого газа стало равно 0,54 атм. „ему равна константа равновеси€ р этой реакции?
73. –авновесные концентрации (моль/л) компонентов газофазной системы, в которой происходила реакци€
3N2H4 ↔ 4NH3 + N2, равны: [N2H4]=0,2; [NH3]=0,4; [N2]=0,25. „ему равна константа равновеси€ обратимой
реакции?
74. –авновесные концентрации (моль/л) компонентов газофазной системы, в которой происходит реакци€
N2 + 3H2 ↔ 2NH3, равны: [N2]=0,12; [H2]=0,14; [NЌ3]=0,1. ќпределите исходные концентрации N2 и H2.
75. –авновесные концентрации компонентов газовой фазы системы, в которой происходит реакци€
—(тв) + —ќ2 ↔ 2—ќ при 1000 и –общ = 1 атм., равны Cќ2 - 17% об. и —ќ - 83% об. „ему равна константа
равновеси€ реакции?
76. онстанта равновеси€ с обратимой газофазной реакции —Ќ4 + Ќ2ќ ↔ —ќ + 3Ќ2 при некоторой температуре равна 9,54 моль2Јл-2. –авновесные концентрации метана и воды равны соответственно 0,2 моль/л и 0,4 моль/л. ќпределите равновесные концентрации —ќ и Ќ2.
77. «апишите взаимосв€зь константы равновеси€ р и энергии √иббса ∆G обратимой реакции, протекающей в изотермических услови€х.
78. ќпределите константа равновеси€ р газофазной обратимой реакции COCl2 ↔ CO + Cl2; ∆H0 = 109,78 кƒж,
∆S0 = 136,62 ƒж/ при 900 .
79. онстанта равновеси€ р газофазной реакции PCl3 + Cl2 ↔ PCl5; ∆Ќ0 = -87,87 кƒж при 450 равна 40,29 атм-1. ќпределите энерги€ √иббса этого процесса (ƒж/ ).
80. «апишите св€зь между р и с обратимой газофазной реакции 2—ќ + 2Ќ2 ↔ —Ќ4 + —ќ2.






