МЕТОДИЧНІ ВКАЗІВКИ
до лабораторних робіт з органічної хімії
(для студентів біологічного факультету денного відділення)
ЗАПОРІЖЖЯ
Державний вищий навчальний заклад
“Запорізький національний університет”
Міністерства освіти і науки України
О.А. Бражко, Л.О. Омельянчик,
М.П. Завгородній, Д.С. Коваленко
МЕТОДИЧНІ ВКАЗІВКИ
до лабораторних робіт з органічної хімії
(для студентів біологічного факультету денного відділення)
Затверджено
вченою радою ЗНУ
Протокол № 4
від 26.12.2006 року
Запоріжжя
УДК: 547.1(076.5)
ББК: 24.2я73
О.А. Бражко, Л.О. Омельянчик, М.П. Завгородній, Д.С.Коваленко
Органічна хімія: Методичні вказівки до лабораторних робіт з органічної хімії (для студентів біологічного факультету денного відділення) – Запоріжжя: ЗНУ, 2007. – с.
Методичні вказівки містять рекомендації та учбові завдання з підготовки з лабораторно – практичних занять з курсу органічної хімії.
Призначений для студентів біологічного факультету спеціальності “Біологія” денної форми навчання.
Загальні методичні вказівки.
Ефективність лабораторно – практичних занять з органічної хімії залежить від рівня попередньо зробленої самостійної роботи студентів. Тому ці методичні матеріали містять рекомендації та учбові завдання з підготовки з лабораторно – практичних занять з курсу органічної хімії.
Самостійну роботу з підготовки до занять необхідно починати з ретельного вивчення теоретичного матеріалу за підручником і конспектом лекцій, а потім ознайомитись з відповідним посібником до практикуму.
Якість опанування вивченого матеріалу слід обов`язково перевірити, відповідаючи на питання та виконуючи вправи й завдання, які приведені у цьому посібнику до кожного з занять.
Кожне лабораторно – практичне заняття складається з двох частин. Одна з них відводиться на теоретичне заняття, включаючи групові семінари та різні вияви ступеня опанування теоретичного матеріалу. Друга, більша частина часу відводиться на виконання практичної роботи та оформлення звіту про роботу.
Мета теоретичною частини занять - поглиблення, поширення та закріплення знань, отриманих на лекціях. Цей вид практикуму сприяє розвиту у студентів хімічного мислення, привчає самостійно працювати з літературою та використовувати отримані знання при виконані лабораторної роботи.
З метою якісного опанування учбової програми з органічної хімії студентами передбачаються різні методи контролю знань. Вибір методу контролю зумовлено ступенем складності вивчаємого теоретичного матеріалу, його практичної значності. В якості основних форм поточного контролю використовується безмашинний контроль на картках, індивідуальний допит, контрольна робота.
Мета лабораторних робіт – закріплення студентами на практиці знань з загальних властивостей, характерних реакціям різних класів органічних сполук.
Лабораторний практикум побудований таким чином, що при його виконанні студенти ознайомляться з основними методами виділення, очищення, ідентифікації, отримання органічних сполук та їх властивостями, здійсняти ряд синтезів.
Перед початком лабораторного практикуму студентам слід обов’язково ознайомитись з правилами роботи у лабораторії та технікою безпеки.
Кожний студент в окремому робочому зошиті веде протокол знань. При оформлені протоколу вказується дата, назва теми, надається короткий опис дослідів, записуються основні реакції та їх механізми, результати спостережень та висновки.
Заняття 1
Правила роботи та техніка безпеки v лабораторії органічної хімії. Теорія будови органічних сполук А.М. Бутлерова. Електронна теорія органічних
Метою заняття є знайомство з правилами роботи та технікою безпеки при роботі у хімічній лабораторії, закріплення знань по теорії будови органічних сполук А.М.Бутлерова, поглиблення понять електронної теорії хімічного зв'язку, формування понять електронних ефектів в молекулах органічних сполук.
Вимоги до знань та уміння:
1. Знати та виконувати правила техніки безпеки при роботі у хімічній лабораторії.
2. Знати та вміти проілюструвати прикладами основні положення теорії будови органічних сполук А.М.Бутлерова.
3. Знати основні типи хімічного зв'язку та електронну будову атому вуглецю (sp3,sp2 , sp - гібридизація).
4. Знати засоби розриву хімічного зв'язку в органічних сполуках, електронну будову вільних радикалів, карбокатіонів та карбоаніонів.
5. Знати класифікацію органічних реакцій за напрямком та характером діючого реагенту.
6. Вміти пояснити та зобразити графічно розподіл електронної щільності
з урахуванням індукційного впливу замісників.
Види самостійних робіт.
1. Робота з підручником, опрацювання лекційного матеріалу.
Слід уважно ознайомитись з правилами техніки безпеки при роботі в,хімічній лабораторії та надання першої допомоги.
Звернути особливу увагу на діалектику уявлень хімічної будови, основні напрямки розвитку класичної теорії будови органічних сполук А.М.Бутлерова, успіхи та перспективи розвитку органічної хімії, співвідношення загально наукових та спеціальних методів пізнань в органічної хімії
2. Для закріплення теоретичних знань виконайте у робочих зошитах наступні вправи та задачі.:
2.1. Яким найбільш простим засобом можна довести структурну формулу етилового спирту?
2.2. Газоподібний вуглеводень має наступний елементарний склад: С-85,71%, Н-14,29%. Щільність його за воднем становить 21. Визначити молекулярну формулу цього вуглеводню.
2.3. Напишіть молекулярну формулу газоподібної речовини, яка має склад: 82,8%-С, 17,2%-Н, якщо відомо, що 1 л цього газу важить 2,59 г (Н.У.)
2.4.3найти молекулярну формулу речовини, якщо при спаленні 13.8г його ваги отримано 26,4 г CO2 та 16,2 г Н2О. Щільність його за повітрям становить 23.
2.5. Яки типи хімічного зв'язку мають місто у молекулі етану, хлорметану, оцтового альдегіду, оцтової кислоти, ацетату натрію?
2.6. Розгляньте електронну просторову будову наступних часток:
a) 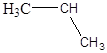 б)
б) 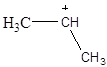 в)
в) 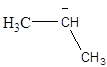
2.7. Вкажіть типи перекриття електронних хмар, при утворенні наступних зв'язків:
а) С- Н в етані, етилені, ацетилені;
б) С - С в етані, етилені, ацетилені;
в)С -СІ;
г)С - О;
2.8. Пояснити та зобразити графічно розподіл електронної щільності в молекулах:
a) CH3 – CH2 – СІ, б) СН3 – СН2 –О – Н, в) 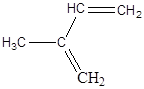 ,
,
г) 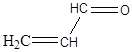 , д)
, д) 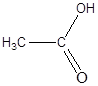
Заняття 2
Насичені вуглеводні (алкани).
Метою занять є закріплення знань взаємозв'язку, складу, будови та властивостей алканів, формування вмінь та навиків виконання лабораторних дослідів, які демонструють властивості алканів, розпізнати вуглеводні насиченого ряду.
Контрольні запитання:
1. Напишіть структурні формули двох найближчих гомологів гептану, які мають в молекулі два третинних атоми вуглецю. Назвіть ці вуглеводні за раціональною та систематичною (ІЮПАК) номенклатурою.
2. Запропонуйте засіб одержання 2,3 - діметилбутану зі сполук, які мають в молекулі число атомів вуглецю 3,6,7.
3. Який об'єм повітря потрібен для спалення:
а) 12 л метану, б) 4,5 л етану, в) 4 л пропану, г) 9,8 л бутану. Скільки СО2 матимемо в кожному з цих дослідів?
4. Напишіть структурну формулу органічної речовини складу С5Н12 якщо відомо, що при її хлоруванні одержуємо третинну хлорпохідну, а при нітруванні - третинну нітросполуку. Поясніть, чому заміщення найбільш легко відбувається у третинного атому вуглецю?
5. Отримайте 3 - етилпентан:
а) гідруванням ненасиченого вуглеводню, б) відновленням галоген похідної.
Скільки ізомерних сполук можна використати для цього у кожному з випадків?
6. Перетворіть бромистий ізобутан у насичений вуглеводень.
а) 3 тією же будовою вуглецевого скелету.
б) З подвійним числом вуглеводневих атомів. Одержання метану та вивчення його властивостей.
Дослід1. Одержання метану та його горіння.
Реактиви та матеріали: натрію ацетат, зневоднений; натронне вапно; бромна вода, насичений розчин; перманганат калію, 1н розчин. Обладнання: газовідвідна трубка.
В суху пробірку, обладнану пробкою з газовідвідною трубкою містять суміш зі зневодненим оцтовокислим натрієм та натронним вапном (приблизно 1:2) (висота шару 6-10 Мм.), потім укріплюють горизонтально та гріють суміш у полум'ї пальника.
Хімізм процесу:
СН3СООNa +NaOH ® CH4 + Na2CO3
Підпалюють одержаний газоподібний метан на кінці газовідвідної трубки. Метан горить блакитно неяскравим полум'ям.
Хімізм процесу:
CH4 + 2O2® CO2 + 2H2O
При нагріванні натрієвої солі оцтової кислоти з натронним вапном відбувається розщеплення солі з утворенням метану. Нагрівання натрієвих солей, карбонових кислот з натронним вапном є загально - лабораторним засобом одержання насичених вуглеводнів.
Дослід 2. Відношення метану до бромної води та перманганату калію.
В пробірку містять 5 крапель розчину перманганату калію, а в іншу 3-5 крапель бромної води. Не зупиняючи нагрівання суміші в пробірці, запроваджують по черзі кінець газовідвідної трубки у пробірки. За звичайних умов алкани стійки до дії окислювачів.
Реакції заміщення в них йдуть у досить жорстких умовах, до реакцій приєднання алкани не здатні.
Дослід 3. Бромування насичених вуглеводнів.
Реактиви та матеріали: рідкі алкани; розчин брому в органічному розчиннику; аміак, 25%-й; лакмусовий папір синій.
Обладнання: пінцет, скляна паличка.
(Дослід проводять у витяжній шафі).
В суху пробірку містять 4 краплі суміші рідких алканів та додають 1 -2 краплі розчину брому. Склад пробірки змішують на холоді. Колір брому при цьому не зникає. Нагрівають вміст пробірки до зникнення забарвлення. До отвору пробірки вносять скляну паличку, змочену розчином аміаку, - з'являться білий димок NH4Br.
Пінцетом вносять до пробірки синій лакмусовий папір, змочений водою, лакмусовий папір червоніє.
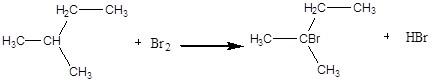
2- метилбутан 2- бром – 2- метилбутан
Реакція бромування рідких алканів супроводжується виділенням бромистого водню і проходить значно повільніше, ніж бромування газоподібних алканів. Бромування йде швидше при доданні каталізаторів - залізних ошурок, амальгамірованого алюмінію, кришталевого йоду. Легше за все галогенують вуглеводні з третинним атомом вуглецю в молекулі, найважче всього заміщуються атоми водню у при первинному атомі вуглецю. Енергія зв'язку водню з третинним атомом вуглецю становить 90 ккал/ моль (376.8 кДж/моль), у вторинного; -94 ккал/моль(393.5 кДж/моль), а у первинного 99ккал/моль (414.5кДж/моль). Різниця у швидкості реакції галогенування особливо позначається при дії брому.
Дослід4. Окислення насичених вуглеводнів.
Реактиви та матеріали: рідкі алкани; перманганат калію, 1н розчин; вуглекислий натрій, 1 н розчин.
У пробірку містять одну краплю дослідженого алкану (або суміші алканів), 1 краплю розчину вуглекислого натрію та 2-3 краплі V перманганату калію. Вміст пробірки енергійно збовтують. Фіолетовий колір водного шару не змінюється.так як алкани за цих умов не окислюються.
Дослід 5. Дія концентрованої сірчаної кислоти на насичені вуглеводні.
Реактиви та матеріали: рідкі алкани; сірчана кислота концентрована (d=1.84r/см).
В пробірку містять 2 краплі рідкого алкану та 2 краплі сірчаної кислоти. Вміст пробірки енергійно перемішують 1-2 хвилини, охолоджуючи пробірку проточною водою. За умов досліду алкани з сірчаною кислотою не реагують При невеликому нагріванні сірчана кислота утворює з алканами, які містять третинний атом вуглецю, сульфокислоти. За високих температур сірчана кислота діє як окислювач.
Дослід 6. Дія концентрованої азотної кислоти на насичені вуглеводні.
Реактиви та матеріали: рідкі алкани; азотна кислота (d=1.4г/см) В пробірку містять 2 краплі дослідженого алкану та додають 2 краплі азотної кислоти. Суміш збовтують на протязі 1-2 хвилин. Ніяких змін в пробірці не спостерігають.
Концентрована азотна кислота на холоді не реагує з алканами, при високій температурі вона діє, як окислювач.
Реакція нітрування алканів добре йде з розмішаною азотною кислотою при нагріванні та підвищеному тиску. Легше за все нітруються алкани, які містять в молекулі третинний атом вуглецю. Алкани легко нітруються у газовій фазі двоокісю азоту або парами азотної кислоти при 250-500 С. Ця реакція йде за радикальним механізмом.
Заняття 3
Насичені вуглеводні ряду етилену (алкени).
Метою занять є закріплення знань про взаємозв'язок складу, будови та властивостей алкенів; поглиблення понять подвійного зв'язку; формування вмінь та навиків виконання лабораторної роботи, яка демонструє властивості алкенів; розпізнавання вуглеводнів ненасиченого характеру.
Контрольні запитання.
1.Напишіть реакції дегідрогенізації бутану, ізопропану. Назвіть продукти реакції.
2. Напишіть схему дегідратації бутилового спирту у присутності сірчаної кислоти.
3. Отримайте вуглеводні етиленового ряду з 1-хлорпентану, 2- йоду-2-метилбутану.
4. Чи відрізняються геометричні ізомери за температурою кипіння та плавлення, за щільністю, за дипольним моментом?
5. Напишіть структурні формули всіх етиленових вуглеводнів, які утворяться при дегідруванні 3,4-діметилгексана.Назвіть їх за номенклатурою ІЮПАК.
6. За допомогою яких реакцій можна розрізнити ізомерні сполуки 2-метил -2-пентен та 3-метил - 2 - пентен?
Дослід 1 Одержання етилену та його горіння.
Реактиви та матеріали: етиловий спирт - 96% розчин; сірчана кислота (d=1.84г/см)
До сухої пробірки містять декілька крихт піску, б крапель етилового спирту та 8 крапель концентрованої сірчаної кислоти..3ачиняють пробірку пробкою з газовідвідною трубкою та обережно гріють суміш у полум'ї пальника. Газ, який виділяється з пробірки, підпалюють на кінці газовідвідної трубки - він горить яскравим полум'ям.
Хімізм процесу:
 етилсірчана кислота
етилсірчана кислота
 Етилсірчана кислота-моноефір неорганічної двохосновної кислоти - при нагріванні розкладається:
Етилсірчана кислота-моноефір неорганічної двохосновної кислоти - при нагріванні розкладається:
CH3 – CH2 – OSO3H ® CH2= CH2 + H2SO4
Таким чином при взаємодії етилового спирту з сірчаною кислотою відбувається дегідратація спирту:
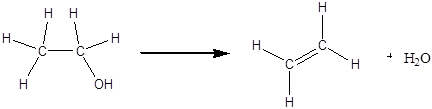
Одержаний етилен горить яскравим полум'ям:
С2H4 + 3O2 ® 2CO2 + 2H2O
Дослід 2. Приєднання брому до етилену.
Реактиви та матеріали: етилен; бромна вода, насичений розчин. Не зупиняючи нагрівання пробірки з сумішшю спирту та сірчаної кислоти, (див. Дослід 1), опускають кінець газовідвідної трубки до пробірки з 5 краплями бромної води. Бромна вода швидко знебарвлюється внаслідок приєднання атомів брому за містом подвійного зв'язку.
Реакція знебарвлення водного розчину брому є якісною реакцією на подвійний зв'язок.
Хімізм процесу:
CH2 = CH2 + Br ® CH2Br – CH2Br
1,2 - диброметан
Дослід 3 Відношення етилену до окислювачів.
Реактиви та матеріали: етилен; перманганат калію, 0.1н розчин. Не зупиняючи нагрівання пробірки з сумішшю спирти та сірчаної кислоти (див. дослід 1), опускають кінець газовідвідної трубки у пробірку з 2ма краплями розчину перманганату калію та 4ма краплями
води. Розчин перманганату калію швидко знебарвлюється. При цьому алкен окислюється у двоатомний спирт.
Ця реакція є якісною реакцію на подвійний зв'язок.
Хімізм процесу:
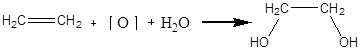
етиленгліколь
Дослід 4. Бромування ненасичених вуглеводнів.
Реактиви та матеріали: рідкі алкени (гас); розчин брому в органічному розчиннику, 25% розчин аміаку; лакмусовий папір синій.
(Дослід проводять у витяжній шафі).
До сухої пробірки містять одну краплю суміші рідких алкенів, додають 1- 2 краплі розчину брому та перемішують суміш.Якщо жовтий колір не зникає, то суміш нагрівають у полум’ї ї пальника до зникнення кольору. В пробірку вносять синій лакмусовий папір, попередньо змочений водою. Колір лакмусового паперу не змінюється. Розчин аміаку внесений на скляній паличці у пробірку не викликає утворення білого диму.
Приєднання брому за містом подвійного зв'язку йде за електрофільним механізмом з утворенням проміжного комплексу.
Хімізм процесу:
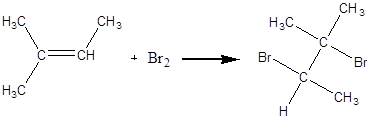
2 – метил – 2 – бутен 2,3 – дибром – 2 - метилбутан
Дослід5. Окислення ненасичених вуглеводнів.
Реактиви та матеріали: рідкі алкени; перманганат калію, 0.1н розчин; карбонат натрію, 1н розчин.
До пробірки містять 1 краплю рідкого алкену, 1 краплю розчину вуглекислого натрію та додають при енергійному збовтуванні 2-3 краплі розчин перманганату калію. Фіолетовий колір зникає та з'являється брунатний колір від утвореного двооксиду марганцю.
Хімізм процесу:
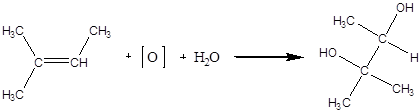
2 – метил – 2,3 – бутандіол Реакція окислення алкенів перманганатом калію у нейтральному, або лужному розчині є аналітичною реакцією на подвійний зв'язок. За більш жорстких умов - у кислому середовищі, а при нагріванні - відбувається розщеплення молекули за містом подвійного зв'язку. За продуктами окислення встановлюється структура алкену та положення подвійного зв'язку
Дослід 6. Дія концентрованої сірчаної кислоти на ненасичені вуглеводні.
Реактиви та матеріали: рідкі алкени, сірчана кислота, (d=l.84г/см) До пробірки містять 2 краплі рідкого алкену та 2 краплі сірчаної кислоти. Вміст пробірки добре перемішують упродовж 1-2 хвилин, охолоджуючи пробірку холодною проточною водою. Суміш розігрівається, шар алкену зникає.
Хімізм процесу:
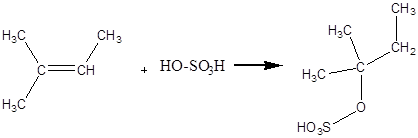
2 – метил – 2 – бутен ізоамілсірчана кислота
Сірчана кислота взаємодіє з алкенами із утворенням алкілсірчаних кислот. Цю реакцію використовують в газовому аналізі для виділення газоподібних алкенів з їх суміші з іншими газами та для одержання спиртів.
Дослід 7. Дія концентрованої азотної кислоти на ненасичені вуглеводні.
Реактиви та матеріали: рідкі алкени; азотна кислота,(d= 1.4г/см). До пробірки містять 2 краплі алкену, який досліджують, та додають 2 краплі азотної кислоти. Вміст пробірки трясуть упродовж 1 хвилини. Суміш. розігрівається та буріє. Внаслідок реакції утворюється складна суміш, яка містить смолоподібні продукти Алкени здатні також приєднувати вищі окисли азоту та хлористий нітрозил CINO з утворенням нітрозитів та нітрохлоридів
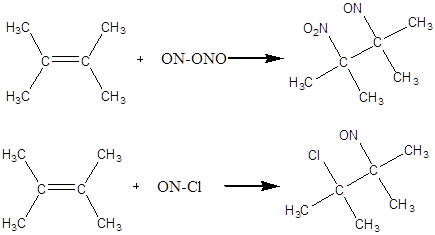
Заняття 4.
Алкіни та дієнові вуглеводні.
Контрольні запитання:
1. Напишіть структурні формулу всіх ацетиленових вуглеводнів які утворюються при гідруванні 2,2-діметилгексану.
2. З карбіду кальцію отримайте бутін-1, а з бромистого бутилу отримайте бутін-2
З. Напишіть структурні формули ізомерних ацетиленових вуглеводнів C7H12,головний ланцюг яких складається з 5 атомів вуглецю. Назвіть їх.
4. За допомогою яких реактивів та за яких умов можливо здійснити перетворення:
а) Пентан-1 в пропілацетилен
б) 3,3- диметилбутен-1 в 3,3- диметилбутін-1
в) Гексан-1 в бутилацетилен
5. Напишіть структурні формули ізомерних дієнових вуглеводнів C5H9. Назвіть їх. Зверніть увагу на цис- та транс ізомерію.
Хід роботи:
Дослід 1. Одержання ацетилену та його горіння.
Реактиви та матеріали: карбід кальцію СаС2(в шматках).
Роботу з ацетиленом треба проводити у витяжній шафі, так як неочищений ацетилен, одержаний з карбіду кальцію, вміщує шкідливі, з неприємним запахом суміші. В пробірку містять шматочок карбіду кальцію СаС2, додають 2 краплі води та зачиняють пробірку пробкою з газовідвідною трубкою, яка має відтягнений кінець. В пробірці бурхливо виділяється газоподібний ацетилен.
Хімізм процесу:
СаС2 + 2Н2О ® НСºСН + Са(ОН)2
Підпалюють ацетилен на кінці газовідвідної трубки. Він горить яскравим копченим полум'ям.
Дослід 2. Приєднання брому до ацетилену.
Реактиви та матеріали: ацетилен, бромна вода, насичений розчин. Додають в пробірку з карбідом кальцію (див. Дослід 1) ще 2 краплі води, та зачиняють пробкою з газовідвідною трубкою, кінець якої опускають у пробірку з 5 краплями бромної води. Бромна вода знебарвлюється внаслідок приєднання атомів брому містом потрійного зв'язку.
Хімізм процесу:
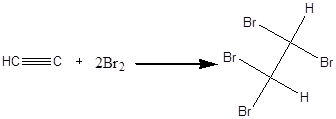
1,1,2,2 - тетрабромметан
Дослід 3 Відношення ацетилена до окислювачів. Реактиви та матеріали: ацетилен; перманганат калію, 0.1н розчин. У пробірку містять 1 краплю перманганату калію та 4 краплі води. В пробірку зі шматками карбіду кальцію додають ще 2 краплі води та зачиняють пробкою з газовідвідною трубкою, кінець якої опускають до приготовленого розчину перманганату калію. Рожевий розчин швидко знебарвлюється: відбувається окислення ацетилену за містом розриву потрійного зв'язку з утворенням проміжного продукту окислення - щавельної кислоти, яка окислюється далі до двооксиду вуглецю:
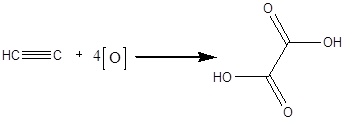
щавлева кислота
Знебарвлення бромної води та розчину перманганату калію доводить ненасиченість ацетилену.
Дослід 4. Утворення ацетиленіду срібла.
Реактиви та матеріали.: ацетилен; нітрат срібла, 0,2н розчин; аміак, концентрований розчин.
До пробірки вносять 2 краплі нітрату срібла та додають 1 краплю розчину аміаку - утворюється осад гідроксиду срібла.При добавлені 1-2 крапель розчину аміаку осад AgOH легко розчиняється з утворенням аміачного розчину оксиду срібла.
Реакція протікає за наступним рівнянням:
AgNO3 + NH4OH ® AgOH + NH4NO3
2AgOH ® Ag2O + H2O
Ag2O + 4 NH4OH ® 2[Ag(NH3)2]OH + 3 H2O
Через аміачний розчин оксиду срібла пропускають ацетилен. В пробірці утворюється світло-жовтий осад ацетиленіду срібла, який потім стає сірим.
Хімізм процесу:
НСºСН + 2[Ag(NH3)2]OH ® Ag – C º C – Ag + 4NH4 + 2H2O
ацетиленісте срібло
Дослід 5. Утворення ацетиленіду міді.
Реактиви та матеріали: карбід кальцію, хлорид міді CuCl, аміачний розчин.
До сухої пробірки містять 1 -2 шматочка карбіду кальцію та додають 2 краплі води. До отвору пробірки вводять смужку фільтрованого паперу, змоченого аміачним розчином хлориду міді CuCl, який містить комплексний аміакат складу. З'являється червоно-буре забарвлення внаслідок утворення ацетиленіду міді.
Хімізм процесу:
НСºСН + 2 CuCl ® Cu – СºС – Cu + 2 HCl
ацетиленіста мідь
2HCl + 2NH3 ® NH4Cl
У водних розчинах ацетиленіди срібла та міді стійки. У сухому стані при нагріванні, або при вдарі вони вибухають зі значною силою. Атоми водню груп СН можуть бути заміщені металами. Це пояснюється тим, що атом вуглецю при потрійному зв'язку має підвищену електро-негативність та електронну хмару зв'язку С-Н зміщену вбік атому вуглецю. Атом водню стає більш позитивним та легше відривається у вигляді протону:
d+ d- d- d+
Н ® С º С Н
Заняття 5.
Ароматичні вуглеводні.
Контрольні запитання:
1.Напишіть структурні формули всіх ізомерних вуглеводнів бензольного ряду складу С8Н10 Назвіть їх.
2. Отримайте усіма відомими Вам засобами етилбензол. Напишіть можливі шляхи його окислення.
3. Встановити будову ароматичного вуглеводню С8Н10 при окисленні.якого отримується фенілдикарбонова кислота, а при нітруванні лише одну мононітропохідну.
4. З бензолу отримайте О- хлорбензойну кислоту.
5. Здійсніть нітрування:
а) хлорбензолу, б) етилбензолу, в) бензойної кислоти, г) О- нітроетилбензолу.
Хід роботи:
Дослід 1. Проба на ароматичну структуру.
Реактиви та матеріали: хлороформ, ароматичний вуглеводень, хлорид алюмінію, зневоднений.
До пробірки додають 5 крапель ароматичного вуглеводню та вносять на кінці мікро лопатки зневоднений хлорид алюмінію. Вміст пробірки ретельно збовтують. Поступово з'являється колір найрізноманітніших відтінків, при відстоюванні переходить у коричневий колір.
Цей дослід можливо здійснити як пробу на ароматичну структуру з будь якою ароматичною сполукою.
Дослід 2.
Реактиви та матеріали: бензойний натрій, натронне вапно; сірчана кислота, концентрована (d=l,84 г/см).
До сухої пробірки містять кілька заздалегідь приготовлених суміші їх бензойнокислого натрію та натронного вапна (II) Пробірку закріплюють в штативі горизонтально й зачиняють пробкою з газовідвідною трубкою, кінець якої опускають в іншу пробірку з водою, охолоджену кригою. Реакційну пробірку нагрівають у полум'ї пальника. Для того, щоб бензол переходив до приймача, спочатку нагрівають верхню частину пробірки, а потім вже реакційну суміш. Через деякий час у приймачі на поверхні води з'являється масляниста пляма бензолу. Після того як реакційна пробірка охолоне, її відчиняють. Відчувається характерний запах бензолу.
Хімізм процесу:
C6H5 – COONa + NaOH ® C6H6 + Na2CO3
бензойнокислий натрій бензол
Дослід 3. Властивості бензолу.
Реактиви та матеріали: бензол х. ч.; етиловий спирт, діетиловий ефір; бромна вода; перманганат калію, 0,1н розчин; сірчана кислота, 2н розчин.
а) розчинність бензолу у будь яких розчинниках. У 3 пробірки містять по 1 краплі бензолу. У одну пробірку додають З краплі води, в другу 3 краплі спирту, в третю 3 краплі ефіру. Вміст пробірок ретельно збовтують. У пробірці з водою утворюється 2 шари, в пробірках зі спиртом та ефіром одержуються однорідний розчин. Отже, бензол у воді практично не розчинень й добре розчиняється в органічних розчинниках.
б) горіння бензолу.(дослід проводять у витяжній шафі)
У фарфорову чашку містять 1 краплю бензол) та підпалюють. Бензол горить яскравим чадним полум'ям.
в) дія бромної води на бензол.
У пробірку містять 3 краплі бромної води та 2 краплі бензолу. Вміст пробірки енергійно збовтують та дають відстоятись. Нижній шар (бромна вода) знебарвлюється, а верхній шар (бензол)забарвлюється в брунатне - жовтий колір. Бром легше розчиняється в бензолі, ніж у воді, й тому переходить до верхнього бензольного шару.
Приєднання брому за цих умов не відбувається.
г) дія перманганату калію.
У пробірку містять 3 краплі води, краплю розчину перманганату калію та краплю розчину сірчаної кислоти. До отриманого розчину додають краплю бензолу та трусять вміст пробірки. Рожевий розчин при цьому не знебарвлюється. Для цього досліду бензол попередньо очищають від домішок, охолоджуючи його до +5 *С. При цьому бензол затвердіє, а домішки залишаються рідкими та легко відокремлюються. Перекристалізацію бензолу роблять 2-3 рази. Однією з важливих властивостей бензолу с його стійкість до дії окислювачів. Найбільш різка відзнака ароматичних вуглеводнів від ненасичених вуглеводнів жирного ряду - відношення до окислювачів.
Дослід 4. Окислення гомологів бензолу.
Реактиви та матеріали: толуол; перманганат калію, 0,1н розчин; сірчана кислота, 2н розчин.
До пробірки містять 3 краплі води, каплю розчину перманганату калію, та 1 краплю розчину сірчаної кислоти. Після цього додають краплю толуолу та енергійно трусять упродовж 1-2 хв. Рожевий колір поступово зникає, розчин знебарвлюється.
Хімізм процесу:
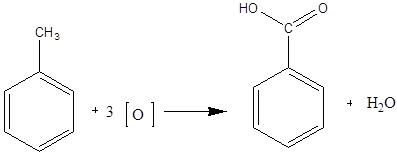
Гомологи бензолу окислюються значно легше бензолу. Але в них ароматичне ядро більш стійке до дії окислювачів, ніж з'єднані з ядром вуглеводневі радикали. Яким би складним не був боковий ланцюг, він при дії сильних окислювачів руйнується, за винятком атому вуглецю, найближчого до ядра. Атом вуглецю поєднаний з ароматичним ядром, окислюється в карбоксильну групу. За основністю, отриманих кислот роблять висновок про структуру гомологів бензолу.
Дослід 5. Бромування ароматичних вуглеводнів.
Реактиви та матеріали: бензол/ толуол; бром (розчин у чотирьоххлористому вуглеці).
(Дослід проводять у витяжній шафі).
Для проведення досліду беруть 2 сухі пробірки.До одної пробірки містять 2 краплі, до іншої 2 краплі толуолу. У обидві пробірки доливають по краплі розчину брому та трусять упродовж 1-2 хв. Ознакою реакції є виділення бромистого водню, чадного на повітрі, та знебарвлення брому. В пробірці з бензолом реакція бромування не спостерігається. Толуол за цих умов бромується повільно але досить чітко.
Вміст обох пробірок нагрівають до кипіння. Толуол при цьому бромується дуже легко, а бензол не бромується навіть при кип'ятінні.
Хімізм процесу:

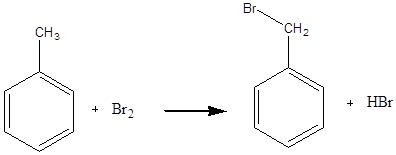
Дія хлору та брому на ароматичні сполуки за умов радикальної реакції (нагрівання та освітлення) приводить до заміщення водню у боковому ланцюгу.
Дослід 6. Одержання бензолсульфокислоти.
Реактиви та матеріали: бензол, сірчана кислота (d=l,84 г/см).
До пробірки містять 3 краплі бензолу та 5 крапель концентрованої сірчаної кислоти. Вміст пробірки нагрівають у киплячий водяній бані при постійному збовтуванні реакційної суміші.
Після отримання однорідного розчину зливають сульфомасу до пробірки з 10 краплями холодної води. Якщо сульфування завершилось повністю ю, то утворюється прозорий розчин, так як сульфокислоти розчинні у воді.
Хімізм процесу:
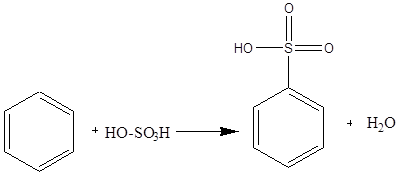
Легкість сульфування при дії сірчаної кислоти також характерна для ароматичних сполук, як і здатність до нітрування. Реакція сульфування, на відміну від реакції галогенування та нітрування - зворотна.
Для того щоб повністю використати сірчану кислоту, реакцію сульфування проводять у надлишку бензолу при нагріванні.
Дослід 7. Одержання трифенілметану.
Реактиви та матеріали: бензол, хлороформ, хлористий алюміній, зневоднений порошок.
(Дослід проводять у витяжній шафі).
До сухої пробірки містять трохи хлориду алюмінію, 4 краплі бензолу та 2 краплі хлороформу. Вміст пробірки трохи нагрівають. Реакція йде дуже енергійно, виділяється гадячій на повітрі хлороводень. Внаслідок реакції утворюється густе забарвлене масло.
Хімізм процесу:
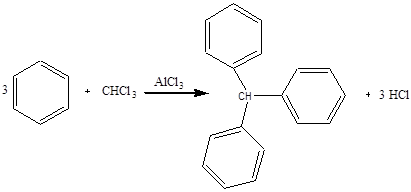
Хлорид алюмінію утворює-з початковими, а іноді з кінцевими продуктами реакції маслоподібні комплексні сполуки. Для виділення чистого остаточного продукту комплекс руйнують соляною кислотою. Три фенольних ядра діють на атом водню при третинному вуглеці, тому цей атом водню мас особливо високу реакційну здатність, легко окислюється. легко заміщується на атом хлору або брому.
Заняття №6
Гідроксильні сполуки та їх похідні.
Контрольні запитання:
1.Які спирти утворюються внаслідок лужного гідролізу:
а) бромистого втор-бугилу б) 1-йод-4 - метилпентану в) 3-бромбутену 2.
І') 2.3-дібромбугану. Назвіть ці спирти?
2. Напишіть рівняння реакції внутрішньо молекулярної дегідратації:
а) 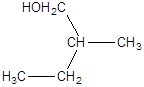
б) 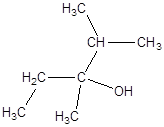
в) 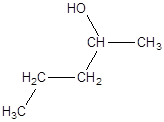
г) 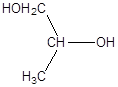
3. Речовина С5Н12O при нагріванні з оцтовою кислотою у присутності Н2SO4 дає сполуку C7H14O2. На першій стадії окислення вона утворює сполуку С5H10O, а при подальшому окисленні - суміш оцтової та пропіонової кислот. Визначити будову речовини С5Н12O Напишіть рівняння всіх перелічених реакцій.
4. Напишіть реакції, за допомогою яких можна розділити первинний, вторинний й третинний спирт.
5. Отримайте будь яким засобом 2,2,4 - триметилпентанон-3.
Напишіть рівняння реакцій:
а) з метилмагній-йодідом,
б) з бромистоводневою кислотою,
в) з оцтовою кислотою у присутностіH2SO4.
6. Напишіть реакціі фенола, які доводять його кислотні властивості.
Дослід 1. Реактиви та матеріали: реактив Лукаса, пропіловий спирт, ізопропіловий спирт, третинний бутиловий спирт.
Беруть 3 пробірки, нумерують восковим олівцем та приливають до кожного по 2 краплі спирту (до першої -пропиловий, до другої ізопропіловий і до третьої - третинний бутиловий спирт). Після цього до пробірок приливають по 5 крапель реактиву Лукаса (хлористий цинк, розчинений у концентрованій соляній кислоті) збовтують вміст пробірок і залишають їх стояти 2 хвилини. У пробірці з пропіловим спиртом розчин залишається прозорим, розчин ізопропілового спирту трохи мутнішає. а у пробірці з третинним бутиловим спиртом утворюється на дні масляна крапля.
За допомогою проби Лукаса можна встановити чи є цей спирт первинним, вторинним або третинним: первинний спирт залишається прозорим, вторинний -мутнішає, а третинний вступає у хімічну реакцію з утворенням галогеналкілу.
Дослід 2. Відношення спиртів до індикаторів.
Реактиви та матеріали: етиловий спирт, пропіловий спирт, бутиловий спирт, ізоамиловий спирт, фенолфталеїн, 1 % - й спиртовий розчин, лакмусовий папір.
До 4 пробірок містять по 3 краплі води та додають по 3 краплі етилового, пропілового, бутилового та ізоамилового спиртів. Випробовують розчини спиртів на фенолфталеїн та лакмус. Колір індикаторів не змінюється. Спирти показують нейтральну реакцію на індикатори.
Дослід 3. Окислення етилового спирту оксидом міді (II).
Реактиви та матеріали: етиловий спирт, фуксинсірчана кислота, спіраль з мідного дроту.
До сухої пробірки містять 2 краплі етилового спирт). Тримаючи спіраль з мідного дроту пінцетом нагрівають її у полум'ї пальника до виникнення чорного нальоту оксиду міді. Ще гарячу спіраль опускають до пробірки з етиловим спиртом. Чорна поверхня негайно стає золотистою внаслідок відновлення оксиду міді. При цьому відчувається характерний запах оцтового альдегіду (запах яблук).
Підтвердженням утворення оцтового альдегіду може служити кольорова реакція з фуксинсірчаною кислотою.
До пробірки містять 3 краплі розчину фуксинсірчаної кислоти та піпеткою вносять одну краплю отриманого розчину. З являється рожево-фіолетове забарвлення (кольорова реакція на альдегід)
Хімізм процесу:
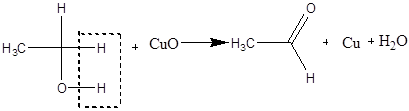
Дослід4. Окислення етилового спирту хромовою сумішшю.
Реактиви та матеріали: етиловий спирт, дихромат калію, 0.5 н розчин сірчана кислота,2 н розчин.
Окислення спиртів за лабораторних умов частіше за все здійснюється хромовою сумішшю. До пробірки містять 2 краплі розчину двохромовокислого калію. Жовтогарячий розчин нагрівають над полум'ям пальника до початку зміни забарвлення на синювато-зелене.
Водночас відчувається характерний запах оцтового альдегід.
Хімізм реакції:

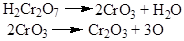
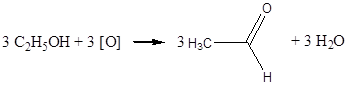
Cr2O3 + 3H2SO4 ® Cr2(SO4)3 + 3H2O
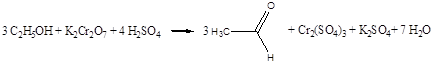
Дослід 5. Взаємодія гліцерину з гідроксидом міді (11).
Реактиви та матеріали: гліцерин, сульфат міді, 0,2 н розчин, їдкий натр, 2 н розчин.
Містять до пробірки 2 краплі розчину сульфату міді, 2 краплі розчину їдкого натру та перемішують - утворюється блакитний студневий осад гідроксиду міді (II). До пробірки додають 1 краплю гліцерину та збовтують вміст. Осад розчиняється та з'являється темно-синє забарвлення внаслідок утворення гліцерату міді.
Хімізм процесу:
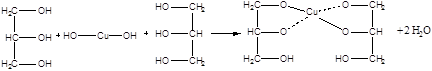
Гліцерин - 3-х атомний спирт. Кислотність його більш, ніж у одноатомних спиртів: збільшення числа гідроксогруп посилює кислотний характер.
Гліцерин легко утворює гліцерати з гідроксидами важких металів. Однак здатність його утворювати металеві похідні (гліцерати) з багатовалентними металами пояснюється не стільки його підвищеною кислотністю, скільки тим, що при цьому утворюється внутришньокомплексні сполуки, які володіють особливою стійкістю.
Сполуки такого типу часто називають хелатними (від грецької -«хела»- клешня).
Дослід 6. Отримання диетилового ефіру.
Реактиви та матеріали: етиловий спирт 96%-й, сірчана кислота.
До сухої пробірки вводять 2 краплі етилового спирту та 2 краплі сірчаної кислоти. Суміш обережно нагрівають над полум'ям пальника до побуріння розчину. До гарячої суміші дуже обережно додають ще 2 краплі етилового спирту. Відчувається характерний запах діетиловогоефіру.
Хімізм процесу:
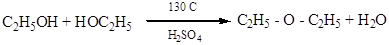
Реакція проходить у дві стадії. Спочатку спирт реагує з сірчаною кислотою, утворюючи кислий складний ефір сірчаної кислоти - етилсульфат, або етилсірчану кислот:
CH3 – CH2OH + HO – SO3H «CH3 – CH2 – OSO3H + H2O
Якщо беремо спирт у надлишку то утворюється простий ефір:
CH3 – CH2 – O - SO3H + CH3 – CH2OH ® CH3 – CH2 – O – CH2 – CH2 – CH3 + H2SO4
Якщо до реакції вступає відносно багато сірчаної кислоти та мало спирту, то при наступному нагріванні (до 160'С) утворюється олефін. Отож у залежності від температури реакцій та кількісних співвідношень спирту та сірчаної кислоти можливі два випадки дегідратації:
а) з утворенням етиленового вуглеводню (внутрішньо-молекулярна дегідратація)
б) з утворенням простого ефіру (міжмолекулярна дегідратація).
Дослід 7. Отримання фенолята натрію.
Реактиви та матеріали: фенол, насичений розчин, їдкий натр, 2н розчин.
До пробірки містять 4 краплі емульсії фенолу в воді та додають 2 краплі розчину їдкого натру. Негайно утворюється прозорий розчин феноляту натрію, т. я. він добре розчиняється у воді. Розчини залишають для наступного досліду.
Хімізм процесу:
C6H5 – OH + NaOH ® C6H5 – ONa + H2O
Феноли володіють кислотними властивостями, вони легко вступають до реакції утворень з водними лужними розчинами, утворюючи аналогічні алкоголятам феноляти.Тому найпростіший фенол назвали «карболовою кислотою». Більш міцний кислотний характер фенолів у порівнянні із спиртами пояснюється впливом бензольного ядра.
Дослід 8. Реакція фенолу з хлоридом заліза (III).
Реактиви та матеріали: фенол, насичений водний розчин, хлорид заліза, 0, 1 н розчин.
Містять до пробірки 2 краплі розчину фенолу, додають 3 краплі води та 1 краплю розчину хлориду заліза. З'являється інтенсивне червоно - фіолетове забарвлення.
Феноли з хлоридом заліза у водному розчині дають кольорову реакцію внаслідок утворення забарвленої сполуки C6H5OFeCl2 або точніше, забарвленого іону C6H5OFe2+. Ця реакція для якісного відкриття фенолів.
Заняття 7.
Альдегіди та. кетони.
Контрольні запитання.
1. Напишіть структурні формули наступних сполук:
а) ізомасляний альдегід, б) метилізобутилкетон, в) 2- метилпентаналь, г)
5,5- диметилгексанон - 3, д) 2- метилгептан-2-ОН- 4
2. Окисленням яких спиртів можна одержати: а) етил - третбутилкетон, б) 3.3- диметилбутаналь.
3. Які сполуки одержуються при сухій перегонці кальцієвих солей сумішей наступних кислот:
а) мурашиної та ізомасляної, б) пропіонової та ізовалеріанової.
Хід роботи:
Дослід 1. Кольорова реакція на альдегіди з фуксинсірчаною кислотою.
Реактиви та матеріали: формальдегід, 40 %-й водний розчин, оцтовий альдегід; фуксинсірчана кислота.
До 2 пробірок містять по 2 краплі розчину фуксинсірчаної кислоти й додають одної з них 2 краплі розчину формальдегіду, а до іншої 2 краплі оцтового альдегіду. Розчин фуксинсірчаної кислоти при доданні розчину формальдегіду поступово забарвлюється у фіолетовий колір, при доданні оцтового альдегіду - у рожево - фіолетовий колір.
Дослід 2. Альдольна конденсація.
Реактиви та матеріали: оцтовий альдегід; їдкий натр, 2н розчин.
Містять у пробірку 3 краплі оцтового альдегіду та 3 краплі розчину їдкого натру. Обережно нагрівають вміст пробірки над полум'ям пальника. Рідина поступово буріє та темніє, з являється різкий запах. Молекули альдегідів можуть поєднуватись друг із другом, утворюючи нові вуглець - вуглецеві зв'язки, відбувається взаємодія карбонільної групи однієї молекули альдегіду 3a- воднем метиленової групи іншої молекули a- водень під впливом сусідньої карбонільної групи здатен відщеплюватись у вигляді протону. Ця реакція відбувається під дією лугів і утворюється карбаніон:
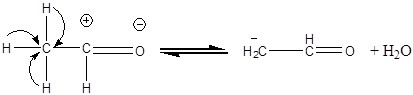
Утворившись карбаніон реагує з карбонільною групою іншої молекули альдегіду (за схемою нуклеофільного приєднання).
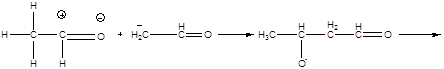
алкоголят – іон

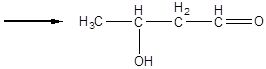
альдоль (3 – оксибутаналь)
Ця реакція називається альдольною конденсацією (реакція О.П.Бородіна). При нагріванні реакційної суміші продукт дегідрується:
Утворившись ненасичений кротоновий альдегід (бутен-2 - аль) має характерний різкий запах. При високій концентрації луги процес ущільнення йде далі і утворюються високомолекулярні забарвлені смоляні продукти.
Дослід 3. Самоокислення водних розчинів формальдегіду.
Реактиви та матеріали: формальдегід, 40 %-й водний розчин, метиловий червоний, розчин.
До пробірки містять 2- 3 краплі розчину формальдегіду та додають 1 краплю індикатору метилового червоного. Розчин приймає забарвлення, що вказує на кисле середовище.
Альдегіди дуже легко окислюються. У водних розчинах в них можуть окислюватись в кислот) за рахунок кисню іншої молекули альдегіду, відновлює її в спирт - відбувається реакція окислювального відновлення (дисмутації ).
Дослід 4. Одержання уротропіну, його гідроліз.
Реактиви та матеріали: 40 %-й водний розчин формальдегіду (формалін): аміак, 2н розчин: 1 %- й спиртовий розчин-соляна кислота. 2н розчин; фуксинсірчана кислот.
До пробірки містять і краплю розчину фенолфталеїну та 2 краплі розчину аміак). Розчин стає рожевим, від додання 1 краплі розчину формальдегіду він знебарвлюється. Додають ще 2 краплі NHОН - розчин стає рожевим, але швидко знебарвлюється, т. я. аміак вступає до реакції з формальдегідом, утворюючи гексаметилентетрамін. або уротропін. Додають по краплям розчин аміаку до виникнень незникаючого рожевого забарвлення, це вказує на те, що весь формальдегід прореагував із аміаком, і с надлишок аміаку.
Кілька крапель одержаного розчину переносять на предметне скло та обережно випаровують воду над полум'ям пальника. На склі залишаються кристали уротропіну, вони мають солодкуватий смак, та не мають запаху.
До залишку розчину уротропіну додають краплю соляної кислоти та кип'ятять при трусінні. Відчувається запах формальдегіду. У пробірку додають 2 краплі розчину фуксинсірчаної кислоти. З'являється рожеве забарвлення, яке свідчить про наявність формальдегіду.
Хімізм процесу:
4NH3 + 6CH2O «C6H12N4 + 6H2O
гексаметилентетрамін, або уротропін
Реакція утворення уротропіну обернена, але гідроліз уротропіну відбувається лише під впливом каталізатору - соляної кислоти, яка зв'язує утворений при гідролізі аміак.
Дослід 5. Окислення альдегідів аміачним розчином оксиду срібла (реакція «срібного дзеркала»).
Реактиви та матеріали: формальдегід, 40 %- й водний розчин; аміак, 2н розчин; нітрат срібла, 0,2 н розчин.
До чистої пробірки вводять 2 краплі розчину нітрату срібла та додають краплю розчину аміаку. Утворений бурий осад гідроксиду срібла розчиняють, додаючи надлишок (1-2 краплі) розчину аміаку. Потім додають краплю розчину формальдегіду і повільно підігрівають вміст пробірки над полум'ям пальника. При обережному нагріванні вміст пробірки буріє та на її стінках може виділитися срібло у вигляді сяючого дзеркального нальоту (комплексний іон металу відновлюється до металевого срібла).Альдегід окислюється до кислоти, яка утворює амонієву сіль.
Хімізм процесу:
AgNO3 + NH4OH ®AgOH + NH4NO3
2AgOH ® Ag2O + H2O
Ag2O +4NH4OH ® 2[Ag(NH3)2]OH + 3H2O
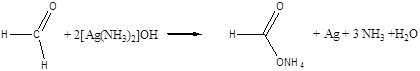
Ця реакція є якісною реакцією на альдегіди.
Дослід 6. Окислення альдегідів гідроксидом міді (II).
Реактиви та матеріали: формальдегід, 40 %- й водний розчин; сульфат міді. 0.2 її розчин; їдкий натр, 2 н розчин.
До пробірки містять 4 краплі розчину їдкого натру, розводять його 4 краплями води та додають 2 краплі розчину сульфату міді. До осаду, який випав гідроксиду міді (II) додають 1 краплю розчину формальдегіду та збовтують вміст пробірки. Нагрівають над полум'ям пальника до кипіння лише верхню частину розчину так, щоб нижня частина залишалася для контролю. У нагрітої частині пробірки виділився жовтий осад гідроксиду міді (І) СuОН, який переходить у червоний оксид міді (І) Cu2O, а іноді на стінках пробірки виділяється навіть металева мідь.
Хімізм процесу:
CuSO4 + 2NaOH ® Cu(OH)2 + Na2SO4
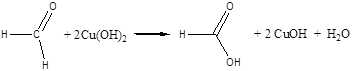
2CuOH ® Cu2O + H2O
Повторить цей дослід, замінивши розчин формальдегіду розчином оцтового альдегіду.
Ця реакція також е якісною реакцій на альдегіди.
Дослід 7. Одержання ацетону з оцтовокислого натрію.
Реактиви та матеріали: оцтовокислий натрій, зневоднений; соляна кислота, концентрована.
До сухої пробірки містять близька 0,1 г зневодненого оцтовокислого натрію CH3COONa (висота шару повинна бути близька 3 мм). Зачиняють пробірку пробкою з газовідвідною трубкою, нижній кінець якої опускають у пробірку з б- 8 краплями води. Тримаючи пробірку з
оцтовокислим натрієм у горизонтальному положенні, нагрівають її у полум'ї пальника. Пари ацетону конденсуються у воді, яка знаходиться у другій пробірці.Відчувається характерний запах ацетону. Після охолодження першої пробірки додають до неї краплю концентрованої соляної кислоти. Відбувається сильне шумування у наслідок виділення двоокисі вуглецю.
Хімізм процесу:
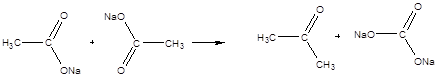
карбонат натрію
Na2CO3 + 2HCl ® CO2 + 2NaCl + H2O
Дослід 8. Окислення бензойного альдегіду киснем повітря.
Реактиви та матеріали: бензойний альдегід.
Містять на предметне скло краплю бензольного альдегіду та залишають на повітрі. Через деякий час з'являються кристали бензойної кислоти, важко розчинні у холодній воді.
Хімізм процесу:
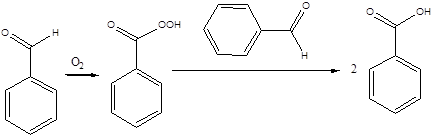
бензальдегід надбензойна кислота бензойна кислота
Ароматичні альдегіди окислюються ще ліпше, ніж альдегіди жирного ряду, утворюючи відповідні ароматичні кислоти. Наприклад, бензойний альдегід легко окислюється до бензойної кислоти не тільки окислювачами, але і киснем повітря, особливо на світлі. В якості проміжного продукту утворюється перекисла сполука - надкислота.
Заняття 8.
Карбонові кислоти.
Контрольні запитання:
1. Скласти структурні формули всіх кислот, ізомерних валеріанової та назвіть їх за раціональною та систематичною номенклатурою.
2. Напишіть структурні формули всіх ізомерних ненасичених кислот складу C4H6O2. Назвіть їх. Для яких з цих кислот характерна геометрична ізомерія?
3. Отримайте ізомасляну кислоту та її хлорангідрид з ізобутилового спирту та необхідних неорганічних реагентів. Напишіть рівняння реакцій.
4. Наведіть приклади схем реакцій, за допомогою яких можна отримати: а) п- бром - бензойну кислоту з толуолу,
б) фталеву кислоту з о- ксилолу. Для синтезу можна використовувати будь які неорганічні сполуки.
5. Розташуйте у ряд, за зменшенням кислотних властивостей, наступні сполуки: а) о- хлорбензойна кислота,
б) бензойна кислота,
в) п-хлорбензойна кислота,
г) п- толуолова кислота,
д) п- нітробензойна кислота.
6. Напишіть рівняння реакцій, які протікають за схемою:
етилен 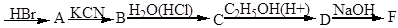
7.Сполука складу С5H10O2 взаємодіє із гідроксидом натрію з утворенням речовини C5H7O2, яка при нагріванні з натровим вапном дає 2- метилпропан. Встановить будову цієї сполуки.
Хід роботи:
Дослід 1. Одержання бензойного калію.
Реактиви та матеріали: бензойна кислота; їдке калі, 1 н розчин; соляна кислота, 1 н розчин.
До пробірки містять кілька кристалів бензойної кислоти та додають З краплі розчину їдкого калі. Трясуть вміст пробірки. Кристали розчиняються.
Хімізм процесу:
C6H5COOH + KOH ® C6H5COOK + H2O
Бензойна кислота з основами утворює солі, її солі з лужними металами добре розчинні у воді, тому бензойна кислота розчинна у лугах. До отриманого прозорого розчину бензойнокислого калію додають 2- З краплі розчину соляної кислоти. Знову випадає бензойна кислота:
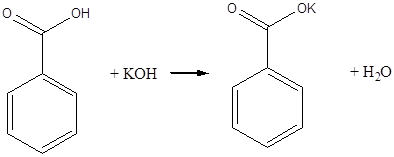
Дослід 2. Окислення мурашиної кислоти перманганатом калію.
Реактиви та матеріали: мурашинокислий натрій; сірчана кислота, 2н розчин; перманганат калію. 0,1 н розчин; баритова вода, насичений розчин.
До пробірки містять кілька крупинок мурашинокислого натрію, додають 2 краплі розчину перманганату калію та 3 краплі розчину сірчаної кислоти. Отвір пробірки зачиняють пробкою з газовідвідною трубкою, кінець якої опускають до пробірки з баритовою водою. Вміст пробірки нагрівають у полум'ї пальника. Через декілька секунд рожевий розчин знебарвлюється, а баритова вода у другій пробірці мутнішає.
Хімізм процесу:
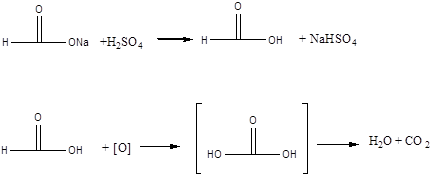
CO2 + Ba(OH)2 ® BaCO3 + H2O
Мурашина кислота на відміну від інших карбонових кислот легко окислюється.
Дослід 3. Одержання натрієвої солі щавлевої кислоти.
Реактиви та матеріали: мурашинокислий натрій, кришталевий -, хлорид кальцію, 0,1 розчину.
До сухої пробірки містять кілька крупинок мурашинокислого натрію та сильно нагрівають на полум'ї пальника. Плавлена сіль розкладається з виділенням водню. Вмісту пробірки дають охолонути, додають до сплаву 3-4 краплі води та злегка нагрівають до появи прозорого розчину. До іншої пробірки містять кілька крупинок мурашинокислого натрію та додають 3-4 краплі води. В обидві пробірки додають по 1 краплі розчину хлориду кальцію. У першій пробірці (щавлевокислим натрієм) утворюється білий осад, який не розчиняється у воді, кальцієвої солі щавлевої кислоти. У пробірці з розчином мурашинокислого натрію осаду не отримаємо, так як кальцієва сіль мурашиної кислоти розчинна у воді.
Хімізм процесу:
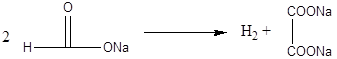
оксалат натрію
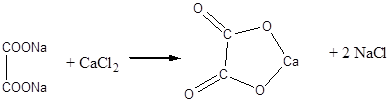
оксалат кальцію
2H – COONa + CaCl2 ® (H – COO)2Ca + 2NaCl
Одержання щавлевої кислоти швидким нагріванням форміату до 420'С є сучасним промисловим засобом її одержання.
Дослід 4. Розкладання щавлевої кислоти при нагріванні з концентрованою сірчаною кислотою.
Реактиви та матеріали: щавлева кислота, кришталева; сірчана кислота (d= 1,84г/ см); баритова вода, насичений розчин.
До пробірки містять кілька кристалів щавлевої кислоти та додають 2 краплі сірчаної кислоти. Пробірку зачиняють пробкою з газовідвідною трубкою та нагрівають на полум'ї пальника. Підпалюють виділений газ - він горить блакитним полум'ям зі спалахами. Після цього кінець газовідвідної трубки опускають у баритову воду. Баритова вода мутнішає.
Хімізм процесу:
HOOC – COOH 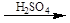 CO +CO2 + H2O
CO +CO2 + H2O
CO2 + Ba(OH)2 ® BaCO3 + H2O
Під дією концентрованої сірчаної кислоти щавлева кислота, на відміну від інших двохосновних кислот, розкладається.
Дослід 5. Одержання оцтовоетилового ефіру.
Реактиви та матеріали: Оцтовокислий натрій, зневоднений; етиловий спирт, сірчана кислота (d = 1,84 г/ см).
До сухої пробірки містять декілька порошку зневодненого оцтовокислого натрію (висота шару повинна бути 1-1,5 мм) та 3 краплі етилового спирту. Додають 2 краплі концентрованої сірчаної кислоти та обережно нагрівають над полум'ям пальника. Незабаром з'являється характерний запах оцтовоетилового ефіру.
Найважливіший засіб одержання складних ефірів - взаємодія карбонових кислот з спиртами (реакція етерифікації). В якості каталізаторів звичайно застосовують концентровану сірчану кислоту.
Хімізм процесу:
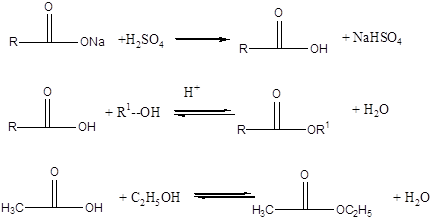
Дослід 6. Одержання бензойноетилового ефіру.
Реактиви та матеріали: бензойна кислота; етиловий спирт, сірчана кислота
(d = 1,84 г/ см).
До пробірки містять кілька кристалів бензойної кислоти, додають 4 краплі етилового спирту та 2 краплі сірчаної кислоти. Вміст пробірки трусять та обережно нагрівають до кипіння. Виливають отриману безкольорову рідину у пробірку з холодною водою. Відчувається характерний запах бензойноетилового ефіру (етилбензоату). Частина бензойної кислоти, яка не ввійшла до реакції, випадає в осад.
Хімізм процесу:
C6H5COOH + C2H5OH «C6H5 –COOC2H5 + H2O
Дослід 7. Визначення ступеню ненасиченості жиру (взаємодія жирів з бромною водою).
Реактиви та матеріали: рослинна олія; твердий жир; бромна вода, насичений розчин; етиловий ефір (або хлороформ).
Беруть 2 пробірки: до однієї з них вносять 1 краплю олії, до іншої - 1 кралю плавленого жиру. У обидві пробірки додають по 3- 5 крапель етилового спирту або хлороформу до розчинення жиру, а потім приливають з бюретки бромну воду, ретельно збовтуючи вміст пробірок. Бромну воду приливають до тих пір, доки не Уявиться стійке жовте забарвлення. Визначають скільки мл бромної води витрачено на бромування твердого та рідкого жиру. Роблять висновок про ступень ненасиченості узятих жирів.
Хімізм процесу:
CH2 – O – CO(CH2)7 – CH = CH – (CH2)7 – CH3
CH2 – O – CO(CH2)7 – CH = CH – (CH2)7 – CH3 + 3Br2 ®
CH2 – O – CO(CH2)7 – CH = CH – (CH2)7 – CH3
CH2 – O – CO(CH2)7 – CHBr - BrCH – (CH2)7 – CH3
® CH2 – O – CO(CH2)7 – CHBr - BrCH – (CH2)7 – CH3
CH2 – O – CO(CH2)7 – CHBr - BrCH – (CH2)7 – CH3
Дослід 8. Окислення рослинних олій перманганатом калію.
Реактиви та матеріали: рослинна олія; перманганат калію, 0,1 н розчин; карбонат натрію, 2 н розчин.
До пробірки містять 2 краплі олії (сонячної), 2 краплі розчину карбонату натрію та 2 краплі водного розчину перманганату калію. Трусять вміст пробірки. Малинове забарвлення перманганату калію зникає, що вказує на окислення гліцеридів ненасичених вищих кислот, які входять до складу олії.
Хімізм процесу:
CH2 – O – CO(CH2)7 – CH = CH – (CH2)7 – CH3
CH2 – O – CO(CH2)7 – CH = CH – (CH2)7 – CH3 + 3[O] +3HOH ®
CH2 – O – CO(CH2)7 – CH = CH – (CH2)7 – CH3
CH2 – O – CO(CH2)7 – CHOH - OHCH – (CH2)7 – CH3
® CH2 – O – CO(CH2)7 – CHOH - OHCH – (CH2)7 – CH3
CH2 – O – CO(CH2)7 – CHOH - OHCH – (CH2)7 – CH3
Дослід 9. Утворення акролеїну при розкладанні жиру.
Реактиви та матеріали: рослинна олія; вершкове масло; гідросульфат калію, кришталевий.
До сухої пробірки містять 2 -3 кристали гідросульфату калію KHSO4 (або натрію) та 1 краплю рідкого жиру або шматочок твердого жиру. Пробірку злегка нагрівають при трусінні, після цього, тримаючи пробірку горизонтально, нагрівають суміш над полум'ям пальника сильніше. Суміш чорніє, виділяються пари води та інші летучі продукти. Відчувається різкий характерний запах акролеїну:
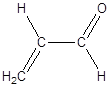
Дослід 10. Видалення вільних жирних кислот з мила.
Реактиви та матеріали: мило, концентрований розчин; сірчана кислота, 2 н розчин.
До пробірки містять 5 крапель концентрованого розчину мила, додають 1 краплю розчину сірчаної кислоти та злегка підігрівають вміст пробірки у полум'ї пальника. Спливає білий маслянистий шар вільних жирних кислот, водний розчин освітлюється. Вміст пробірки залишають.
Хімізм процесу:
C17H35 – COONa + H2SO4 ® C17H35 – COOH + NaHSO4
стеаринова кислота
Мила - солі вищих насичених та ненасичених органічних кислот. Тверде мило - суміш натрієвих солей пальмітинової, стеаринової та олеїнової кислот.
Заняття 9.
Аміно -. діазо - та азо сполуки.
Контрольні запитання:
1. Напишіть структурні формули всіх ізомерних амінов складу C4H11N. Назвіть їх за історичною та систематичною номенклатурою, вкажіть серед них первинні, вторинні та третинні аміни.
2.Наведить структурні формулі ізомерних ароматичних амінів складу C7H9N та назвіть їх.
3. Напишіть рівняння реакції одержання із етилену наступних амінів: а) етиламіну; б) пропіламіну; в) триетиламину; г) етилпроламину.
4. Напишіть рівняння реакцій одержання речовин, які протікають за схемою:
2 – метил – 1 – пропен 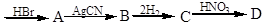
5. Встановить будову речовини складу С5H13N, яка із соляною кислотою; утворює сіль C5H14NCl, з азотною кислотою взаємодіє з виділенням азоту та утворенням речовини складу С5Н12O, яке при окисленні дає кетон, а за більш жорстких умов окислюється до оцтової та пропіонової кислот.
6. Із якої маси нітробензолу можна одержати 182 г аніліну, якщо вихід останнього становить 78%?
7. Напишіть рівняння реакцій, які відбуваються за схемою:
п-нітрогліцерин 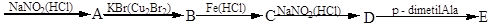
Назвіть одержанні продукти.
8. За допомогою яких хімічних реакцій можна одержати ізомерні аміни:
а) толуїдин; б) бензиламін; в) N метилані






