План
Внутренняя энергия.
Первое начало термодинамики.
Изопроцессы.
Работы при изопроцессах.
Адиабатический процесс.
Теплоемкость.
1. Внутренняя энергия тела.
Внутренняя энергия тела слагается из кинетической энергии поступательного и вращательного движения молекул, кинетической и потенциальной энергии колебательного движения атомов в молекулах, потенциальной энергии взаимодействия между молекулами и внутримолекулярной энергии (внутриядерной).
Кинетическая и потенциальная энергия тела как целого не входит во внутреннюю энергию.
Внутренняя энергия термодинамической системы тел слагается из внутренней энергии взаимодействия между телами и внутренней энергии каждого тела.
Работа термодинамической системы над внешними телами заключается в изменении состояния этих тел и определяется количеством энергии, которую термодинамическая система передает внешним телам.
Теплота - это количество энергии, представляемое системой внешним телам при теплообмене. Работа и теплота не являются функциями состояния системы, а функцией перехода из одного состояния в другое.
Термодинамической системой – называют такую систему, совокупность макроскопических тел, которые могут обмениваться энергией между собой и с внешней средой (с другими телами) (Например, жидкость и находящийся над ней пар). Термодинамическая система характеризуется параметрами:
P, V, T, ρ и т.д.
Состояния системы, когда хотя бы один из параметров изменяется, называется неравновесными.
Термодинамические системы, которые не обмениваются с внешними телами энергией, называются замкнутыми.
Термодинамический процесс – переход системы из одного состояния (P1,V1,T1) в другое (P2,V2,T2) – нарушение равновесия в системе.
2. Первое начало термодинамики.
Количество теплоты, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
Первый закон термодинамики - это специальный случай закона сохранения энергии, учитывающий внутреннюю энергию системы:
Q=U2-U1+A;
U1, U2 - начальное и конечное значения внутренней энергии тела.
A - работа, совершаемая системой.
Q - Количество теплоты, сообщаемое системе.
В дифференциальном виде:
d  Q=dU+d
Q=dU+d  A;
A;
DU - есть полный дифференциал, и он зависит от разности начального и конечного состояния системы.
d  Q и d
Q и d  A – неполные дифференциалы, зависят от самого процесса, то есть от пути совершения процесса. Работа совершается тогда, когда изменяется объем:
A – неполные дифференциалы, зависят от самого процесса, то есть от пути совершения процесса. Работа совершается тогда, когда изменяется объем:
d  A=Fdx=pSdx =pdV;
A=Fdx=pSdx =pdV;
 | |||||
| |||||
| |||||








|
d  A=pdV;
A=pdV;
Первое начало термодинамики - невозможен вечный двигатель первого рода, то есть двигатель, который совершал бы работу в большем количестве, чем получаемая им извне энергия.
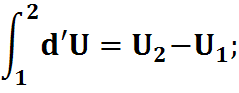
- не зависит от пути интегрирования.


- зависит от пути интегрирования функции процесса и нельзя записать:
A2 - A1; Q2 - Q1;






