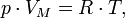Основные положения молекулярно-кинетической теории (МКТ) формулируются следующим образом:
1. Любое вещество имеет дискретное (прерывистое) строение. Оно состоит из отдельных частиц (молекул, атомов, ионов), разделенных промежутками.
2. Частицы находятся в состоянии непрерывного хаотического движения, называемого тепловым.
3. Частицы взаимодействуют друг с другом. В процессе их взаимодействия возникают силы притяжения и отталкивания.
Справедливость МКТ подтверждается многочисленными наблюдениями и фактами.
Наличие у веществ проницаемости, сжимаемости и растворимости свидетельствует о том, что они не сплошные, а состоят из отдельных, разделенных промежутками частиц. С помощью современных методов исследования (электронные и ионные микроскопы) получены изображения наиболее крупных молекул.
Броуновское движение и диффузия свидетельствуют о том, что частицы находятся в непрерывном движении.
Наличие прочности и упругости тел, явления смачивания, поверхностного натяжения в жидкостях и т.д. доказывают существование сил взаимодействия между молекулами.
Масса и размеры молекул.
Размер молекул является величиной условной. Его оценивают следующим образом. Между молекулами наряду с силами притяжения действуют и силы отталкивания, поэтому молекулы могут сближаться лишь до некоторого расстояния. Расстояние предельного сближения центров молекул называют эффективным диаметром молекулы. (При этом условно считают, что молекулы имеют сферическую форму.)
С помощью многочисленных методов определения масс и размеров молекул установлено, что за исключением молекул органических веществ, содержащих очень большое число атомов, большинство молекул по порядку величины имеют диаметр 1• 10 - 10 м и массу 1• 10 - 26 кг.
Относительная молекулярная масса.
Относительной молекулярной (или атомной) массой Мr (или Аr) называют величину, равную отношению массы молекулы (или атома) mо этого вещества к 1/12 массы атома углерода mоС
Относительная молекулярная (атомная) масса является величиной, не имеющей размерности.
Количество вещества. Молярная масса. Масса молекулы.
Количеством вещества ν называют величину, равную отношению числа молекул (или атомов) N в данном теле к числу атомов NA в 0,012 кг углерода, т.е. ν = N/ NA (NA - число Авогадро).
Молярной массой М какого-либо вещества называют массу 1 моль этого вещества.
Экспериментальные газовые законы- Закон Бойля- Мариота (1662 г., 1667 г.)
При постоянной температуре газа (Т=const) давление газа обратно пропорционально объему:
pV = const =  RT. Закон Гей- Люссака (1802 г.)
RT. Закон Гей- Люссака (1802 г.)
Для данной массы газа при постоянном давлении (р=const) объем газа меняется с температурой линейно.
Закон Шарля (II з. Гей- Люссака)
Для данной массы газа при постоянном объеме (V=const) давление газа меняется с температурой линейно.
Закон Авогадро (1811 г.)
При одинаковых давлениях и температурах в равных объемах газа содержится одинаковое число молекул.
Закон Дальтона (1801 г.)
Давление газовой смеси равно сумме парциальных давлений входящих в нее газов.
p = p1 + p2 + …
16) Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид: