Механізм процесу анодного розчинення металу.
Протікання струму в електролітичному осередку здійснюється за допомогою руху іонів під дією прикладеного зовнішнього електричного поля.
Рідкі розчини, провідні електричний струм за рахунок іонної провідності, називаються електролітами.
При ЭХРО як електроліти використовуються водні розчини неорганічних солей NaCl, NaNO3,Na2SO4 і ін. рідше за кислоти і луги. Питома электропроводимость електролітів знаходиться в межах (0,1-0,4) 0м см, а їх температура в інтервалі (4-60) оС. При цьому застосовують так звані сильні електроліти, в яких всі молекули розчиненої речовини диссоциируют на аніони (Аn-) і катіони (Кn+).
Наприклад, водний розчин куховарської солі (NaCl) диссоциирует на Na+ (катіон) і Cl- (аніон). Окрім цього сама вода містить іон водню Н+ і гидроксила (ВІН) -.
За відсутності зовнішнього електричного поля (електроди розімкнені) іони рухаються в електроліті хаотично і електричного струму в нім не спостерігається. При цьому на межі розділу твердої і рідкої фази (металевого електроду і електроліту) утворюються два електрично заряджених шаруючи: поверхневий шар металу, заряджений позитивно або негативно, і шар іонів, що має протилежний заряд.
Між цими шарами встановлюється певний потенціал, який називається рівноважним (Fр). Цей потенціал вимірюється щодо стандартного водневого електроду, потенціал якого за всіх умов приймається рівним нулю.
Підключення електродів осередку до джерела напруги зрушує їх потенціали від рівноважних: і викликає протікання електродних процесів.
На аноді відбувається: 1) основна реакція - розчинення (окислення) металу з утворенням гідрата окислу металу, выпадаемого в осад при обробці в нейтральних і лужних електролітах.
(2.1) Ме — ne —> Men+; Men+ + n OH- —>Me(OH)n
де n - валентність металу (Ме)
або з утворенням розчинної солі при обробці в кислотах
(2.2) Men+ + n R- —>Me(R)n
і 2) можлива побічна реакція - утворення кисню, знижуюча К.П.Д. процесу анодного розчинення:
(2.3) 2 OH- - 2 e —> H2O +O; O+O—>O2
На катоді відбувається виділення водню, процес утворення якого залежно від умов протікає по разному:
а) у кислотах і при малій щільності струму в нейтральних і слабо лужних розчинах відновлення водню здійснюється по схемі:
(2.4) H+ + e —> H; H+H—>H2
б) у нейтральних розчинах при великій щільності струму і великій напрузі на електродах утворення молекулярного водню може здійснюватися за рахунок розкладання молекул води:
(2.5) H2O + e —> H+ OH-; H+H—>H2
Перераховані рівняння відображають лише кінцевий результат процесу анодного розчинення, який є сукупністю складних взаємозв'язаних процесів (дифузійних, міграції іонів, виділення тепла, гідродинаміки електроліту в зазорі, утворення окисних плівок і ін.). Схема взаємодії основних процесів анодного розчинення представлена на мал. 2.3.
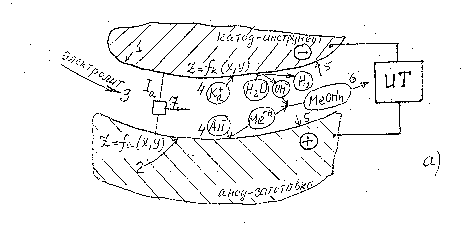
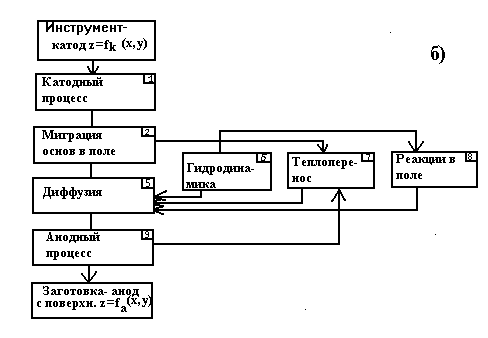
Мал. 2.3. Схема міжелектродного проміжку (а) і взаємодія основних процесів анодного розчинення (б).
Характер електрохімічних реакцій і технологічних показників ЭХРО залежать від кислотності і щелочности електроліту, який оцінюють водневим показником рН. При обробці значної кількості деталей в одному і тому ж електроліті його рН підвищується до 9-11, що погіршує умови розчинення металів.
Для збереження постійності шорсткості обробленої поверхні, швидкості знімання і енергоємності процесу здійснюють стабілізацію рН електроліту за рахунок буферирования розчину, наприклад, борною кислотою в кількості 3-30 г/л.
Про характер протікання електродних процесів можна судити по поляризаційних кривих, які є залежністю між щільністю струму (i) і потенціалом на електроді (F), що порівнюється з потенціалом стандартного водневого електроду.
Розглянемо вплив умов обробки (мал. 2.4) на процес анодного розчинення. Хай спочатку обробка здійснюється в нерухомому електроліті (мал. 2.4, крива 1). Тоді при потенціалах близьких до рівноважного Fp1 (а - зона), спостерігається режим активного анодного розчинення. Проте, подальше збільшення потенціалу приводить до освіти на поверхні анода оксидів металу, що розчиняється, і до гальмування швидкості розчинення, не дивлячись на зростання електродного потенціалу. Крім того, із-за можливої адсорбції кисню, розчиненого у воді, анодна поверхня може покриватися пасивуючими з'єднаннями і при нижчих потенціалах, ніж рівноважний потенціал утворення оксидів (Fp2). Таке явище гальмування швидкості анодного процесу називається пасивацією. Повна пасивація наступає при так званому потенціалі Фладе (Fп).
Якщо потенціал пасивного електроду збільшити, то при деякому значенні Fпп (потенціал перепассивации) починається розчинення оксидів. Знову різко зростає анодний струм, тобто поверхня металу стає активною.
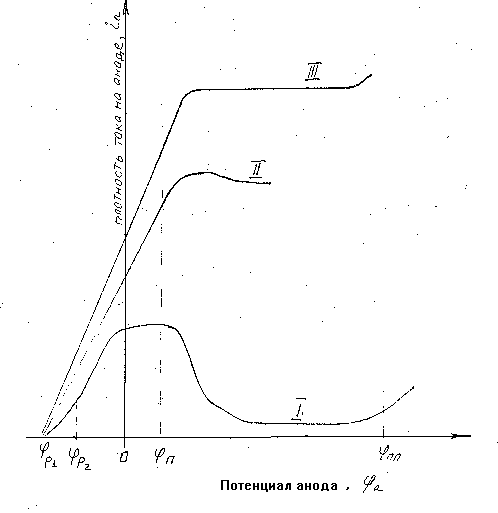
Мал. 2.4. Схематичні поляризаційні характеристики за різних умов анодного розчинення:
1- обробки в нерухомому електроліті, 2- обробки в рухомому електроліті без активуючих аніонів, 3- обробки в рухомому електроліті з активуючими аніонами.
Значний вплив на анодні явища пасивацій надає швидкість прокачування електроліту уздовж поверхні оброблюваної деталі (анода). Із зростанням цієї швидкості збільшується швидкість відведення іонів Ме і пасивація наступає лише при великій щільності струму.
Для багатьох сплавів (на основі нікелю, заліза, хрому і ін.) усунення їх пасивації можливо досягти введенням в електроліт активуючих аніонів (Сl-, Вr - і ін.), які в певних умовах частково або повністю витісняють кисень з пассиввирующих з'єднань і утворюють розчинні і легко диссоциирующие в електроліті з'єднання (наприклад, FeCl2).






