Молекулярная физика
Тепловое движение молекул. Межмолекулярное взаимодействие. Агрегатные состояния вещества. Идеальный газ.
Тепловое движение (атомов или молекул) — процесс хаотического (беспорядочного) движения частиц, образующих вещество.
Неверно смешивать понятия «Тепловое движение» и «Броуновское движение». Броуновским называется движение видимых взвешенных в веществе частиц; тепловым — движение частиц самого вещества. Тепловое движение является причиной броуновского движения.
Межмолекулярное взаимодействие - взаимодействие между электрически нейтральными молекулами или атомами; определяет существование жидкостей и молекулярных кристаллов, отличие реальных газов от идеальных и проявляется в разнообразных физических явлениях. Межмолекулярное взаимодействие зависит от расстояния r между молекулами и, как правило, описывается потенциальной энергией взаимодействия U(r) (потенциалом М. в.), так как именно средняя потенциальная энергия взаимодействия определяет состояние и многие свойства вещества. Впервые были учтены Я. Д. Ван-дер-Ваальсом в 1873 году. Учёт межмолекулярных сил необходим для объяснения свойств реальных газов и жидкостей.
Агрегатное состояние — состояние вещества, характеризующееся определёнными качественными свойствами: способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка и другими. Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Изменения агрегатного состояния это термодинамические процессы, называемые фазовыми переходами. Выделяют следующие их разновидности: из твёрдого вещества в жидкое — плавление; из жидкого в газообразное — испарение и кипение; из твёрдого в газообразное — сублимация; из газообразного в жидкое или твёрдое — конденсация.
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Температура и внутренняя энергия.
Внутренняя энергия тела (обозначается как E или U) — полная энергия этого тела за вычетом кинетической энергии тела как целого и потенциальной энергии тела во внешнем поле сил. Это термодинамическая функция состояния системы, ее энергия, определяемая внутреннем состоянием. В. э. складывается в основном из кинетической энергии движения частиц (атомов, молекул, ионов, электронов) и энергии взаимодействия между ними (внутри- и межмолекулярной). На В. э. влияет изменение внутреннего состояния системы под действием внеш. поля; во В. э. входит, в частности, энергия, связанная с поляризацией диэлектрика во внеш. электрическом поле и намагничиванием парамагнетика во внешнем магнитном поле. Кинетическая энергия системы как целого и потенциальная энергия, обусловленная пространств, расположением системы, во В. э. не включаются. В термодинамике определяется лишь изменение В. э. в различных процессах.
 , где:
, где:
 — подведённая к телу теплота, измеренная в джоулях
— подведённая к телу теплота, измеренная в джоулях
 — работа, совершаемая телом против внешних сил, измеренная в джоулях.
— работа, совершаемая телом против внешних сил, измеренная в джоулях.
3. Уравнение состояния идеального газа (Менделеева-Клайперона). Частные случаи уравнения состояния (P,V,T=const). Графические изображения.
Уравнение состояния идеального газа — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
 где
где
 — давление,
— давление,
 — молярный объём,
— молярный объём,
 — универсальная газовая постоянная
— универсальная газовая постоянная
 — абсолютная температура,
— абсолютная температура,
Так как  , где V — количество вещества, а
, где V — количество вещества, а 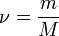 , где m — масса, M — молярная масса, уравнение состояния можно записать:
, где m — масса, M — молярная масса, уравнение состояния можно записать:

Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона. R – молярная газовая постоянная, равна 8,31 Дж моль в -1 степени умножить на К тоже в -1 степени.
 Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
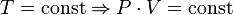 - закон Бойля- Мариотта (рисунок) – изотермический процесс
- закон Бойля- Мариотта (рисунок) – изотермический процесс
 - закон Гей- Люссака – изобарный процесс (рисунок)
- закон Гей- Люссака – изобарный процесс (рисунок)
 - закон Шарля – изохорный процесс (рисунок)
- закон Шарля – изохорный процесс (рисунок)






