С доисторических времен известно, что люди, переболевшие смертельно опасной «черной» оспой, повторно ею не болеют, и древние китайцы, стремясь обезопасить себя от нее, вкладывали в носовую полость высушенные оспенные струпья больных, а индейцы втирали порошок из них в кожные надрезы, надеясь перенести легкую форму инфекции и приобрести пожизненный иммунитет. Не трудно представить, что заражение оспенным детритом, в котором, как мы теперь знаем, ортопоксвирус, сохраняя имму-ногенность, утрачивает присущую ему природную патоген-ность, зачастую приводило к трагическим последствиям, а сами «привитые» становились источниками инфекции для окружающих.
Практически безопасное оспопрививание было начато английским врачом Эдуардом Дженнером. Наблюдая в течение многих лет за больными и убедившись, что перенесшие коровью оспу крестьянки-доильщицы, на руках у которых, как и на вымени коров, возникало несколько бесследно исчезающих пустул, никогда не болеют натуральной оспой, он 14 мая 1796 г. в присутствии врачебной комиссии в кожные надрезы 8-летнего Джемса Фиппса привил лимфу, взятую из кисти доярки, больной коровьей оспой, а спустя 16 дней заразил его гноем пустулы ос-
пы человека без каких бы то ни было последствий для здоровья ребенка. Начатая Дженнером вариоляция «из ручки на ручку» привела затем к созданию дермальной противооспенной вакцины, массовое применение которой во всех странах закончилось в 1977 г. полной ликвидацией натуральной оспы на Земле.
Отмечая заслуги Э. Дженнера перед человечеством, основоположник микробиологии и иммунобиологии великий Луи Пастер в конце XIX в. предложил все препараты, в том числе собственные, предназначенные для специфической профилактики инфекционных болезней, называть вакцинами (лат. vacca - корова).
Антивирусные вакцины представляют собой антигены, которые, как и все другие, активируя иммунокомпетентные клетки организма, вызывают образование иммуноглобулинов и развитие многих других защитных иммунологических процессов, обеспечивающих невосприимчивость к вирусным инфекциям. При этом создающийся ими искусственный антивирусный иммунитет, так же как и постинфекционный, возникает через 10— 14 дней и в зависимости от качества вакцины и индивидуальных особенностей организма сохраняется от нескольких месяцев до нескольких лет. Массовые прививки позволяют создать коллективный активный иммунитет и обеспечить эпидемиологическое благополучие населения. Они регулируются государственными законами и проводятся по эпидемическим показаниям при угрозе вирусных эпидемий, большом риске заболевания при выезде в регионы с природной очаговостью по особо опасным вирусным инфекциям или осуществлении плановых декретированных (лат. decretum - постановление) прививок.
Классификация вакцин
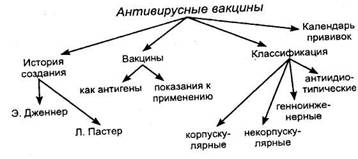
Для специфической профилактики вирусных инфекций в настоящее время предложено 4 группы вакцин: корпускулярные, некорпускулярные, генноинженерные и антиидиотипические. Широкое использование получили, главным образом, корпускулярные вакцины, остальные три группы вакцин, имеющие большой научно-практический интерес, не вышли пока из стадии разработок.
Корпускулярные вакцины. Представляют собой суспензии или лиофилизированные массы живых ослабленных или убитых вирионов из зараженных ими культур клеток, куриных эмбрионов, различных органов и тканей животных, очищенных, насколько это возможно, от балластных клеточных веществ, способных вызвать побочные реакции.
Живые вирусные вакцины. Принципы создания живых вакцин против инфекционных болезней разработал Луи Пастер, показав, что патогенные микроорганизмы утрачивают болезне-творность без существенного снижения иммуногенности при естественном старении; длительном выращивании без пересевов на свежие питательные среды; культивировании при повышенных температурах (42—43 °С) или при воздействии на них других неблагоприятных факторов; пассировании через организм устойчивых к ним организмов. Использовав эту методологию, он получил три ослабленных (по его терминологии аттенуированных) вакцинных штамма микроорганизмов для специфической профилактики куриной холеры, сибирской язвы и бешенства.
Пастеровская вакцина против бешенства явилась первой прививкой против вирусных инфекций, созданной в искусственных условиях. Задолго до открытия вирусов, ничего, по существу, не зная о них, Пастер с гениальной прозорливостью сумел предугадать, что невидимый под микроскопом возбудитель бешенства должен находиться в истекающей из пасти больных собак слюне, и для того, чтобы ослабить болезнетворность дикого (уличного) вируса, ввел ее под твердую мозговую оболочку кролика, высокоустойчивого к бешенству, никогда не болеющего им в природных условиях. Признаки болезни у него проявились после инфицирования только через 3 недели. Получив вытяжку из зараженного мозга животного, Пастер продолжил пассажи дикого вируса. На 133-м пассаже дикий вирус трансформировался в слабо патогенный для собак фиксированный штамм, закономерно вызывающий через 7 сут. бешенство у кролика. На конечном этапе изготовления своей антирабической вакцины (единственной и поныне), Пастер предложил высушивать инфицированный мозг кролика под парами калийной щелочи, дополнительно аттенуируя содержащийся в нем вирус-фикс.
Введение кроличьей мозговой взвеси с ослабленным таким образом вирусом предохраняло от заболевания собак, заразивщихся уличным (диким) вирусом бешенства. Для профилактики бешенства у людей антирабическая вакцина начала применяться с 1885 г., когда Пастер решился ввести ее Иосифу Мейстеру (9 лет) и Жану Жупилю (15 лет), тяжело искусанным бешеной собакой. 1 марта 1886 г. на заседании Французской Академии наук Пастер сделал свой исторический доклад о спасении им от бешенства 350 человек.
Используя методологию Пастера, ученые к настоящему времени получили живые вирусные вакцины против желтой лихорадки, полиомиелита (вакцина Сэйбина), кори, эпидемического паротита, краснухи, гриппа. Как и антирабическая вакцина, все они моновакцины, содержащие аттенуированные разными приемами генетически стабильные варианты (мутанты) диких вирусов, индуцирующие иммунитет по отношению к соответствующей инфекции. Ведутся интенсивные поиски создания универсальной моновакцины на основе авирулентных вирусов, родственных по антигенной структуре многим другим. Имеются, в частности, данные об апробации вакцины из малайского флаво-вируса Лангат, который якобы может создать перекрестный иммунитет ко многим флавивирусным инфекциям.
Ослабленные вакцинные штаммы вирусов, если исключить противогриппозные, обычно создают достаточно напряженный и длительный иммунитет. Так, поствакцинальный иммунитет к натуральной оспе у большинства прививаемых лиц сохраняется многие годы, к желтой лихорадке - 9 лет, к полиомиелиту и кори - от 2-3 до 5 лет и больше. Объясняется это тем, что вакцинные штаммы, сохраняя иммуногенность, способны к размножению в организме привитых и, вызывая сглаженную по тяжести проявления мини-инфекцию, оказывают длительное воздействие на иммунную систему организма.
Вводятся вирусные живые вакцины накожно или подкожно, противогриппозная - интраназально и энтерально, противопо-лиомиелитная вакцина Сейбина - per os. Применяют живые вакцины с соблюдением противопоказаний, так как они могут отличаться высокой реактогенностью, в частности антирабическая вакцина у некоторых привитых вызывает менингоэнцефалиты, Другие вакцины - аллергии, не исключены осложнения в виде генерализации вакцинного процесса.
Убитые вакцины. Готовят убитые вакцины из концентрированных стандартных взвесей вирусов. Инактивируют их, как правило, формальдегидом, реже ультрафиолетовым облучением. Формолвакцинами, в частности, являются противополиомие-литная поливалентная вакцина Солка, против клещевого весенне-летнего энцефалита, создающая перекрестный иммунитет к омской геморрагической лихорадке, противоаденовирусная, краснушная, гриппозная, а УФ-вакцинами - в основном противогриппозные. Самая иммуногенная из них — вакцина Солка, которая создает такой же напряженный и длительный иммунитет, как и живая вакцина Сейбина. Продолжительность поствакцинального иммунитета других прививок не превышает 12 мес.
Вводятся убитые вакцины подкожно 2-3 раза с интервалом 2-3 - 4 недели.
Некорпускулярные вакцины. Разрабатывается два вида некорпускулярных вакцин - субъединичные и синтетические (рис. 3). Те и другие представляют собой вакцины из чистых вирусных антигенов. Субъединичные вакцины готовятся из структурных субъединиц внешних оболочек сложных вирионов, в частности путем растворения липидного бислоя детергентами с последующим центрифугированием, в процессе которого от нуклеокапсидов отделяют гликопротеиды. Полученные таким образом субъединичные вакцины из гликопротеидов, не содержащие балластных веществ, оказались малореактогенными, но, к сожалению, слабо иммуногенными. Практическое применение получила только противогриппозная вакцина из гемагглютини-нов и нейраминидаз, обладающих свойствами протективных антигенов. Синтетические вакцины создают путем синтеза вирусных детерминант протективных антигенов, но они, как иммуно-гены, тоже не оправдали возлагавшихся на них надежд. В связи с этим делаются попытки усилить иммунный ответ полученных вирусных антигенов конъюгированием их со специально подобранными белками-носителями и иммуностимуляторами, которые активируют иммунокомпетентные клетки и антителообра-зование. Для повышения иммуногенности сконструированные пептидные фрагменты вирусных белков встраивают в липосомы (липидные пузырьки) или везикулы, образованные детергентом JSCOM, что помогает проникновению антигена в цитозоль клеток и способствует развитию цитотоксического ответа, необходимого для реализации противовирусной защиты.
|
|


Рис. 3. Принцип конструирования субъединичных и синтетических вакцин: / - вирион; 2 - субъединичная вакцина без носителя; 3 - субъединичная вакцина с носителем; 4 - субъединичная вакцина с носителем и иммуностимулятором
Генноинженерные вакцины. Генноинженерные вирусные вакцины - это искусственно созданные рекомбинантные вирусы, в геном которых введены гены других вирусов, кодирующих один или несколько специфических антигенов. Таким путем, в частности, уже создан рекомбинантный вирус осповакцины, синтезирующий поверхностный HBs-антиген вируса гепатита В; кодирующий гемагглютинин вируса гриппа А; гликопротеины вирусов простого герпеса и везикулярного стоматита. Сложность их применения в том, что прокариотические клетки, например кишечные палочки, в которые обычно вводятся рекомбинантные вирусы, не могут обеспечить синтез полноценных антигенов вирусов человека. Для экспрессии их генов необходимы клетки высших эукариот. Правда, экспрессия HBs-антигена вируса гепатита В успешно осуществлена в дрожжевых клетках, отличающихся полной безвредностью для организмов.
Антиидиотипические вакцины. Представляют собой мо-ноклональные антиидиотипические антитела, имеющие сходную с детерминантой антигена конфигурацию или, как чаще говорят, несущие ее «внутренний образ». Для их получения используют гибридомы, отобранные после иммунизации животных моно-клональными антителами.
Схематически осуществляют это следующим образом. Мо- ноклональными антителами иммунизируют мышей или крыс. Получив лимфоциты селезенки, продуцирующие соответствую-щие к ним антитела, с помощью полиэтиленгликоля, разрушающего клеточные стенки, их сливают с опухолевыми (бес-' смертными) дефектными линиями В-клеток. Взвесь этих клеток затем высевают на элективную для гибрида ГАТ-среду, содержащую гипоксантин, аминоптерин и тимидин, но неблагоприятную как для нормальных лимфоцитов, так и для опухолевых В-
клеток.
Получить чистый клон гибридом в ГАТ-среде удается только в том случае, если в лунке микропанели для культур клеток будет находиться одна особь гибрида. Каждая гибридома наследует присущие родительским клеткам свойства: от антителообра-зующей - способность продуцировать высокоспецифические ан-тиидиотипические иммуноглобулины, а от опухолевой В-клетки -способность к перевиваемости и неограниченному росту.
Календарь профилактических антивирусных прививок.
Введенный в действие с 1 января 2000 г. план антивирусных прививок применяется в отношении широко распространенного вирусного гепатита В, циклических подъемов кори, эпидемического паротита, краснухи и угрозы возникновения паралитических форм полиомиелита. При этом профилактика гепатита В проводится рекомбинантной вакциной, содержащей очищенный HbsAg, в первый день после рождения, через 1 месяц, в 5 месяцев с ревакцинацией в 13 лет; против полиомиелита - поливалентной живой аттенуированной вакциной Сейбина, применяемой через рот, в 3, 4 и 5 месяцев с ревакцинацией в полутораго-
довалом возрасте, в 2 года и при достижении 7 лет; а против кори, эпидемического паротита и краснухи - живыми аттенуированными моновакцинами или же тривакциной из соответствующих вакцинальных штаммов трех вирусов в возрасте одного года с ревакцинацией в 6 лет.
ХИМИОТЕРАПИЯ ВИРУСНЫХ ИНФЕКЦИЙ
Ввиду того что вирусы не обладают собственным обменом веществ и процессы репродукции их тесно связаны с биосинтетическими функциями клеток, найти селективно действующие на них химио-терапевтические вещества до сих пор не удалось. Намечены лишь пути создания и отбора антивирусных препаратов, обладающих способностью: 1) препятствовать проникновению вируса в клетку и 2) нарушать синтез вирионных нуклеиновых кислот и белков.
В частности, к препаратам, ингибирующим прикрепление, проникновение и раздевание вирусов, относятся амантадин и ремантадин, являющиеся производными адамантанамина гидрохлорида. Оба они ингибируют репродукцию вирусов кори, краснухи, везикулярного стоматита, тогавирусов, но особенно - вирус гриппа А. Так как мишенью их действия является начальная стадия репродукции вирусов, то для получения лечебного эффекта их надо применять в первый день заболевания. При эпидемиях гриппа амантадин и ремантадин назначаются с профилактической целью. Препараты малотоксичны и при перораль-ном употреблении суточная доза может составлять 150-300 мг.
Более широко в практике лечения вирусных инфекций используются ингибиторы вирусных нуклеиновых кислот, главным образом аномальные нуклеозиды. Среди них чаще всего применяют пиримидиновый аналог йодоксиуридин, пуриновые аналоги аденин-арабинозид (Ара-А) и ациклогуанозин (ацикловир) и рибавирин (виразол) с очень сложной химической структурой.
В основе антивирусного действия этих и других нуклеозидов леит внутриклеточное фосфорилирование до инертных нук-
леотидов, в процессе которого аномальные нуклеозиды, конкурируя с естественными за ферменты, ингибируют синтез природных нуклеотидов и вирусных нуклеиновых кислот. Встраивание инертных нуклеотидов в вирусные нуклеиновые кислоты приводит затем к полной их инактивации.
Йодоксиуридин, Ара-А и ацикловир оказывают ингибирую-щее действие на ДНК-вирусы и применяются в основном для лечения простого герпеса, герпетических кератитов, ветряной оспы, опоясывающего герпеса, цитомегалии. Чаще используются местно в виде 0,5-5%-х мазей или 0,1-0,5%-х растворов. Изредка, соблюдая большую осторожность в дозировках, Ара-А вводится внутривенно. Рибаварин подавляет репродукцию ДНК-и РНК-вирусов, в частности ингибирует вирусы герпеса, оспо-вакцины, миксо-, энтеро- и риновирусы. Назначается перораль-но в дозах 400-600 мг в день для взрослых.
По конечному эффекту антивирусного действия близкими аномальным нуклеозидам являются производные тиосемикарба-зонов, особенно изатин-Р-тиосемикарбазон, или метисазон. Препарат ингибирует синтез структурных белков и процесс сборки поксвирусов, в результате чего они утрачивают инфекционные свойства. Высокая вирусспецифическая активность ме-тисазона была доказана в 1963 г. во время эпидемии натуральной оспы в Индии. Так, из 2610 человек (опытная группа), контактировавших с больными и получавших препарат, заболели 18 и умерли 4, а в такой же контрольной группе (2710 чел.) - заболели 113 и умерли 21. В другом случае в опытной группе из 1101 человека заболели 3, а в контрольной из 1126-78. Назначался метисазон в виде суспензии перорально в дозе 200 мг/кг, а затем по 500 мг/кг массы тела дробными дозами в течение двух суток. Сейчас, как уже указывалось, натуральная оспа ликвидирована, но некоторая опасность возникновения обезьяньей оспы осталась (см. «Поксвирус натуральной оспы»).
Синтез вирусных белков нарушают гордокс, контрикал и е-аминокапроновая кислота. Все они являются ингибиторами про-теолитической активации белков-предшественников вирусов, т. е. подавляют его нарезание, ингибируя клеточные и вирусспе-цифические протеазы. Антивирусное действие этих ингибиторов протеолиза отмечается при всех инфекциях, вызванных РНК-вирусами, но наиболее ярко проявляется в отношении вирусов гриппа, парагриппа, пикорна-, тога-, арено- и ротавирусов.
Самым широким спектром антивирусного действия обладают недавно полученные рекомбинантные интерфероны - реаферон, реальдирон, виферон, роферон, интрон, берофор (все на основе ос-ИНФ), бетаферон, гаммаферон и особенно комплексный препарат лейкинферон, содержащий наряду с интерферонами интерлейкины 1, 6 и фактор некроза опухолей а, подавляющие как РНК-, так и ДНК-вирусы.