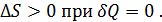Количество теплоты, полученное (отданное) системой, идет на изменение ее внутренней энергии и на совершение работы самой системой:
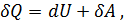
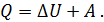
Первое начало термодинамики является выражением закона сохранения энергии применительно к тепловым и механическим процессам.
Энтропия
Молекулы, ударяясь друг с другом и со стенками сосуда, обмениваются с ними энергией и перемещаются из области с большим давлением туда, где давление меньше. Если температура стенок поддерживается постоянной, то и внутри сосуда во всех его точках установится такая же температура. При этом везде установится одинаковое давление, а значит, и плотность.
Термодинамическое равновесие – это состояние системы, в котором во всех ее точках температура и давление одинаковы.
Если систему каким-нибудь образом вывести из состояния равновесия, то при постоянстве температуры стенок она через некоторое время вернется в состояние равновесия. Если процесс изменения состояния системы будет идти очень-очень медленно, то эта система будет успевать возвращаться в состояние равновесия, но уже при других параметрах.
Процесс изменения состояния системы, в ходе которого система из одного равновесного состояния переходит в другое равновесное состояние, называется равновесным процессом.
Если равновесный процесс изменения состояния системы может быть также равновесно проведен в обратном направлении через те же промежуточные состояния, то такой процесс называется обратимым процессом.
Все реальные процессы являются неравновесными и необратимыми. Например:
1) реальный процесс теплообмена между горячим и холодным телами, который приводит к установлению теплового равновесия,
2) реальный процесс смешения двух газов.
Необратимость реальных процессов обусловлена специфическими свойствами самой теплоты и внутренней энергии, связанной с движением огромного числа частиц. Механическая энергия может самопроизвольно перейти в тепло, но тепло никогда самопроизвольно не перейдет в механическую энергию.
Причина в том, что самопроизвольный переход системы, состоящей из огромного числа частиц, из одного состояния в другое по направлению к равновесному состоянию есть движение системы от менее вероятных состояний к более вероятным, но никак не наоборот. При этом увеличивается статистический вес системы.
Системы, состоящие из огромного числа частиц, обладают особым свойством, которое называется энтропией (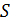 ).
).
Энтропия – это функция состояния термодинамической системы, которая прямо пропорциональная логарифму статистического веса этой системы.
Формула Больцмана:
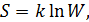
где 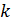 – постоянная Больцмана.
– постоянная Больцмана.
Эта формула раскрывает вероятностный (статистический) смысл энтропии.
Энтропия измеряется в Дж/К и ее изменение связано с количеством теплоты.
Термодинамическое определение энтропии:
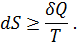
Эта формула определяет именно приращение энтропии, а не саму энтропию. Знак равенства в случае обратимого процесса теплопередачи, а знак «больше» в случае необратимого процесса.
С поступлением в систему теплоты энтропия системы возрастает, с потерей теплоты энтропия системы уменьшается.
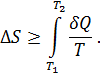
Поскольку все реальные процессы необратимы, энтропия теплоизолированной (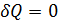 ) системы всегда возрастает – закон возрастания энтропии.
) системы всегда возрастает – закон возрастания энтропии.