Известно, что эквивалентность теплоты и работы является опытным подтверждением всеобщего закона сохранения и превращения энергии, согласно которому энергия не исчезает и не возникает вновь, она лишь переходит в различных физических (а также химических) процессах из одного вида в другой.
Закон сохранения и превращения энергии в применении к понятиям термодинамики носит название первого закона термодинамики.
Опыт показывает, что подвод теплоты Q к какому-либо телу (так же, как и отвод теплоты), обычно связан с изменением температуры тела Т и его объема V.
Изменение температуры обусловлено изменением энергии движения молекул вещества. Этот вид энергии называется внутренней энергией, понимая под ним сумму кинетической и потенциальной энергий атомов и молекул тела.
В общем случае внутренняя энергия тела складывается из кинетической энергии поступательного, вращательного и колебательного движений молекул, потенциальной энергии сил сцепления (отталкивания) между молекулами, внутримолекулярной, внутриатомной и внутриядерной энергии.
Если количество внутренней энергии рабочего тела до начала подвода теплоты к этому телу обозначить через U1, а количество внутренней энергии этого же тела после окончания подвода теплоты через U2, то результатом процесса будет изменение внутренней энергии:
 .
.
Для определения разности ΔU нет необходимости знать, по какому закону происходит подвод теплоты к телу. Поэтому внутренняя энергия тела может быть отнесена к группе параметров состояния.
Изменение объема тела при нагревании (или охлаждении) связано с работой, которую производят возникающие в этом процессе силы, проявляющиеся в форме давления на поверхность тела.
 |
Работа этих сил в процессе подвода теплоты Q называется внешней работой L. Отсюда следует, что затрата теплоты Q при изменении температуры и объема тела связана с изменением внутренней энергии ΔU и совершением внешней работы L, и следовательно, в соответствии с законом сохранения энергии
Данное соотношение называют обычно аналитическим выражением первого закона термодинамики для неподвижного тела. Это выражение устанавливает, что в данном термодинамическом процессе теплота расходуется в двух направлениях: на изменение внутренней энергии и на совершение внешней работы.
В технической термодинамике принимают, что основной формой преобразования теплоты во внутреннюю энергию является изменение кинетической энергии движения молекул (как функции изменения температуры) и потенциальной энергии сил сцепления между молекулами (как функции изменения удельного объема):
U = f(T; v).
Для идеальных газов силы сцепления между молекулами равны нулю, и следовательно, внутренняя энергия таких газов зависит только от их абсолютной температуры:
U = f(T).
Уравнение первого закона термодинамики, устанавливающего связь между подведенным к телу теплом q, изменением внутренней энергии Δu и внешней работой 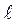 , при расчете на единицу массы тела примет следующий вид
, при расчете на единицу массы тела примет следующий вид
q = Δu + 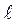 .
.






