Лабораторная работа № 2
Определение термодинамических характеристик
Процесса гидролиза соли
Цель работы: определить зависимость степени гидролиза соли h от концентрации (разбавления) раствора при различных температурах. Рассчитать термодинамические характеристики процесса гидролиза соли: изобарно-изотермический потенциал DG, энтальпию DН и энтропию DS.
Гидролиз –реакция обменного разложения между различными веществами и водой.
Протолитическая теория кислот и оснований Бренстеда-Лоури позволяет рассматривать процесс гидролиза солей как частный случай кислотно-основного равновесия в растворе. Напомним, что под гидролизом солей понимают обменное взаимодействие ионов соли с водой, сопровождающееся образованием малодиссоциированного соединения (слабойкислоты или слабого основания) и, как следствие, изменением рН среды. Количественными характеристиками процесса гидролиза являются степень h и константа гидролиза КГ.
Для соли с катионным типом гидролиза
NH4NO3 + H2O = NH4OH + HNO3
NH4+ + H+OH- = NH4OH + H+,
выражение для константы равновесия процесса гидролиза

содержит две постоянные величины – собственно константу равновесия и концентрацию воды в разбавленном растворе, которые и принято объединять в константу гидролиза

| (2.1) |
где СГ - концентрация гидролизованных молекул соли, равная концентрации образовавшихся ионов водорода и молекул NH4OH; С –исходная концентрация молекул соли в растворе.
Доля гидролизованных молекул характеризуется степенью гидролиза h
| h = СГ/С. | (2.2) |
Подставив уравнение (2.2) в (2.1), получим выражение, связывающее степень и константу гидролиза

| (2.3) |
Для разбавленных растворов солей степень гидролиза невелика (h «1), и константа гидролиза КГ приближенно равна
| КГ= h2С. | (2.4) |
При катионном гидролизе концентрация гидролизованных молекул СГ равна концентрации ионов водорода [H+], т.е. СГ = [H+], соответственно
| h = [H+]/ С | (2.5) |
| КГ = [H+] 2 /С. | (2.6) |
Для солис анионным типом гидролиза
СH3COONa + H2O = СH3COOH + NaOH
СH3COO- + H2O = СH3COOH + OH-
концентрация гидролизованных молекулравна 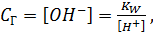 тогда
тогда

| (2.7) |

| (2.8) |
где  - ионное произведение воды.
- ионное произведение воды.
Термодинамические характеристики процесса гидролиза соли определяются по уравнениям (2.9-2.11) изотермы (ΔG), изобары (ΔH) и из уравнения Гиббса (ΔS):
| ΔG = - R·T·lnKГ = - 2,303· R ·T·lgKГ, | (2.9) |
ΔH = 2,303· R ·1g · ·  , ,
| (2.10) |
 . .
| (2.11) |
Порядок выполнения лабораторной работы
При выполнении лабораторной работы исследуются растворы одной из трех солей: NH4Cl, NH4NO3, CH3COONa пяти концентраций (0,4; 0,2; 0,1; 0,05; и 0,025 М) при двух температурах (комнатной и температуре из диапазона40 - 70ºС по заданию преподавателя).
1.Рассчитать навеску заданной соли для приготовления 100 мл 0,4 М раствора с точностью до 0,001 г.
2. Приготовить 0,4 М раствор соли. Для этого навеску сухой соли, взятую с точностью 0,01 г на технических весах, поместить в мерную колбу на 100 мл. Сначала растворить соль в небольшом количестве воды, затем тщательно перемешать раствор и осторожно довести водой до метки.
3. Приготовить 0,2 М раствор соли. Для этого отобрать 50 мл раствора из первой колбы, перенести его в мерную колбу на 100 см3 и довести водой раствор до метки.
4. Аналогично, путем последовательного разбавления, приготовить растворы соли 0,1; 0,05 и 0,025 М концентрации. Растворы, оставшиеся в колбах, использовать для измерения рН.
5. Измерить рН растворов всех пяти концентраций при комнатной температуре. Затем, после выдержки стаканчиков с растворами в термостате в течение 20-30 минут, измерить рН при второй заданной температуре.
6. Рассчитать степень и константу гидролиза для растворов соли пяти концентраций при двух температурах,результаты занести в таблицу 2.1.
При каждой температуре определить среднее арифметическое значение константы гидролиза и сравнить полученную величину с теоретической. Теоретическую константу гидролиза определяют из соотношения

Истинные константы диссоциации слабой кислоты (основания) и ионное произведение воды возьмите из справочной литературы с учетом температуры эксперимента.
Таблица 2.1
Определение степени и константы гидролиза соли
| t,°С | Концентрациясоли СМ,моль/л моль/л | рН=-lg[H+] | [H+], моль/л | h | КГ | V=1/С, л/моль |
| t1= = … | 0,4 0,2 0,1 0,05 0,025 | |||||
| t2= = … | 0,4 0,2 0,1 0,05 0,025 |
7. Построить график зависимости степени гидролиза соли h от разбавления (величина, обратная концентрации V=1/C) h = f(V) для двух температур.
8. Рассчитать термодинамические характеристики процесса гидролиза. Результаты расчетов занести в табл. 2.2.
Таблица 2.2
Термодинамические характеристики процесса гидролиза соли
| t,°С | Т, К | КГ | ΔG, кДж/моль | ΔН, кДж/моль | ΔS, Дж/моль·К |
9. Сделать выводы о зависимости
- степени гидролиза соли от величины разбавления раствора (или концентрации),
- степени гидролиза от температуры,
- изменения изобарно-изотермического потенциала от температуры.
Объяснить полученные результаты с позиций принципа ЛеШателье - Брауна. Оценить вклад энтальпийного и энтропийного факторов в изменение изобарно-изотермического потенциала процесса гидролиза.
Измерениеводородного показателя рН при помощирН-метра.
В основе используемого в работе потенциометрического метода определения рН среды лежит линейная зависимость потенциала измерительного электрода (стеклянный электрод) от концентрации ионов водорода в растворе. Потенциал второго электрода, называемого электродом сравнения, остается постоянным и никак не связан с рН раствора. Поэтому измеряемая величина ЭДС (разность потенциалов двух электродов) зависит только от потенциала стеклянного электрода, а значит и от рН исследуемого раствора.
Предварительная калибровка рН-метра проводится по стандартным буферным растворам с известными значениями рН при комнатной температуре в соответствии с инструкцией к данной модели рН-метра. Цель калибровки - построение линейной зависимости между измеряемой величиной ЭДС и значением РН раствора, которая автоматически заносится в память прибора и позволяет при дальнейшей работе снимать показания в единицах рН.
1. Прибор включить в сеть и прогреть в течение 20 минут. Электроды при этом должны быть погружены в стаканчик с чистой дистиллированной водой.
2. Перейти в режим «Изм.» для измерения рН. Проконтролировать величину рН дистиллированной воды.
3. Электроды аккуратно осушитьот воды фильтровальной бумагой и только после этого погрузить в исследуемый раствор. Электроды выдерживают в растворе до получения стабильной величины рН (или до звукового сигнала прибора).Время установления показаний не должно превышать 2-3 минут.
4. После проведения измерения электроды тщательно промытьдистиллированной водой, осушить и провести измерение рН в растворе с другой концентрацией.
5. В промежутках между измерениями электроды погружают в дистиллированную воду, ав нерабочие периоды хранят в насыщенном растворе KCl. Нельзя допускать длительного контакта электродов рН-метра с воздухом, это приводит к пересыханию мембраны стеклянного электрода и потере им рабочих характеристик.
6. По окончании работы отключить прибор от сети.






