ќсновн≥ закони ≥ формули
| –≥вн€нн€ лапейрона-ћенделЇЇва | pV =  RT RT
| p Ц тиск (ѕа) V Ц обТЇм (м3) m Ц маса газу (кг) μ Ц мол€рна маса (кг/моль) ν Ц к≥льк≥сть речовини (моль) R Ц газова стала (ƒж/моль× ) “ Ц абсолютна температура ( ) NA Ц стала јвогадро (моль-1) n Ц концентрац≥€ (м-3) |
| ћаса молекули | m0 = 
| |
| ≥льк≥сть речовини | ν = 
| |
| ≥льк≥сть молекул | N =  NA NA
| |
| онцентрац≥€ молекул | n = 
| |
| ќсновне р≥вн€нн€ молекул€рно- к≥нетичноњ теор≥њ газ≥в (ћ “) | p =  nw0,
p = nkT
pV = nw0,
p = nkT
pV =  Wк Wк
| Wк Ц к≥нетична енерг≥€ поступаль-ного руху молекул (ƒж) w0 Ц середн€ к≥нетична енерг≥€ одн≥Їњ молекули (ƒж) n Ц концентрац≥€ молекул (м-3) k Ц стала Ѕольцмана (ƒж/ ) |
| —ередн€ квадра-тична швидк≥сть молекул |
Jкв .=  = = 
| m0 Ц маса одн≥Їњ молекули R Ц ун≥версальна газова стала (ƒж/моль× ) μ Ц мол€рна маса (кг/моль) “ Ц абсолютна температура ( ) k Ц стала Ѕольцмана (ƒж/ ) |
| Ќайб≥льш ≥мов≥рна швидк≥сть молекул |  = = 
| |
| —ередн€ арифметич-на швидк≥сть моле-кул |  = = 
| |
| ћол€рна теплоЇмн≥сть ≥деального газу при пост≥йному обТЇм≥ | 
| R Ц ун≥версальна газова стала (ƒж/(моль× )) —v Ц мол€рна теплоЇмн≥сть при сталому обТЇм≥ (ƒж/(моль× )) —р Ц мол€рна теплоЇмн≥сть при сталому тиску (ƒж/(моль× )) с Ц питома теплоЇмн≥сть (ƒж/(кг× )) μ Ц мол€рна маса (кг/моль) ≥ Ц число ступен≥в в≥льност≥ ≥= 3 Ц дл€ одноатомних молекул ≥= 5 Ц дл€ двохатомних молекул ≥= 6 Ц дл€ багатоатомних молекул |
| ћол€рна теплоЇм-н≥сть ≥деального газу при пост≥йному тиску | —  
| |
| –≥вн€нн€ ћайера | —р Ц —v = R | |
| «вТ€зок мол€рноњ ≥ питомоњ теплоЇм-ностей | —= μс | |
| ѕоказник ад≥абати | γ =  = = 
|
| ≈нерг≥€ теплового руху молекул (внутр≥шн€ енерг≥€ газу) | U  × × 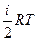
| μ Ц мол€рна маса (кг/моль) ≥ Ц число ступен≥в в≥льност≥ R Ц ун≥версальна газова стала (ƒж/моль× ) “ Ц абсолютна температура ( ) |
| —ередн€ довжина в≥льного проб≥гу молекул газу | 
|  Цсередн€ к≥льк≥сть з≥ткнень кож-
ноњ молекули з ≥ншими за одиницю
часу (с-1) Цсередн€ к≥льк≥сть з≥ткнень кож-
ноњ молекули з ≥ншими за одиницю
часу (с-1)
 Ц середн€ арифметична швидк≥сть (м/с)
d Ц ефективний д≥аметр молекул (м)
n Ц концентрац≥€ молекул (м-3) Ц середн€ арифметична швидк≥сть (м/с)
d Ц ефективний д≥аметр молекул (м)
n Ц концентрац≥€ молекул (м-3)
|
| «акон ‘≥ка оеф≥ц≥Їнт дифуз≥њ | M = - ƒ  ƒ=
ƒ= 
| M Ц маса речовини (кг)
 Ц град≥Їнт густини (кг/м4)
r Ц густина речовини (кг/м3)
S Ц площа (м2)
t Ц час (с)
ƒ Ц коеф≥ц≥Їнт дифуз≥њ (м2/с)
F Ц сила внутр≥шнього терт€ (Ќ) Ц град≥Їнт густини (кг/м4)
r Ц густина речовини (кг/м3)
S Ц площа (м2)
t Ц час (с)
ƒ Ц коеф≥ц≥Їнт дифуз≥њ (м2/с)
F Ц сила внутр≥шнього терт€ (Ќ)
 Ц град≥Їнт швидкост≥ (с-1)
h Ц коеф≥ц≥Їнт вТ€зкост≥ (ѕа×с) Ц град≥Їнт швидкост≥ (с-1)
h Ц коеф≥ц≥Їнт вТ€зкост≥ (ѕа×с)
 Ц середн€ арифметична швидк≥сть (м/с) Ц середн€ арифметична швидк≥сть (м/с)
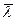 Ц середн€ довжина в≥льного проб≥гу (м)
Q Ц к≥льк≥сть теплоти, €ка пере-носитьс€ у насл≥док теплопро-в≥дност≥ (ƒж) Ц середн€ довжина в≥льного проб≥гу (м)
Q Ц к≥льк≥сть теплоти, €ка пере-носитьс€ у насл≥док теплопро-в≥дност≥ (ƒж)
 Ц град≥Їнт температури ( /м)
χ Ц коеф≥ц≥Їнт теплопров≥дност≥ (¬т/м× )
—V Ц мол€рна теплоЇмн≥сть при сталому обТЇм≥ (ƒж/(моль× )) Ц град≥Їнт температури ( /м)
χ Ц коеф≥ц≥Їнт теплопров≥дност≥ (¬т/м× )
—V Ц мол€рна теплоЇмн≥сть при сталому обТЇм≥ (ƒж/(моль× ))
|
| «акон Ќьютона оеф≥ц≥Їнт внутр≥ш- нього терт€ (вТ€зкост≥) | F= - 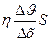

| |
| «акон ‘урТЇ оеф≥ц≥Їнт теплопров≥дност≥ | Q= - χ  χ=
χ= 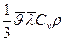
| |
| ≥льк≥сть теплоти | Q =сmΔT Q =λm | с Ц питома теплоЇмн≥сть (ƒж/(кг× )) m Ц маса (кг) ΔTЦ зм≥на температури ( ) λ Ц питома теплота згоранн€ палива (ƒж/ ) |
|
|
|
| ѕерший початок термодинам≥ки | Q = DU + A, | Q Ц к≥льк≥сть теплоти (ƒж)
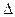 U Ц зм≥на внутр≥шньоњ енерг≥њ (ƒж)
ј Ц робота проти зовн≥шн≥х сил
(ƒж)
μ Ц мол€рна маса (кг/моль)
≥ Ц число ступен≥в в≥льност≥
R Ц ун≥версальна газова стала (ƒж/моль× )
Δ“ Ц зм≥на температури ( ) U Ц зм≥на внутр≥шньоњ енерг≥њ (ƒж)
ј Ц робота проти зовн≥шн≥х сил
(ƒж)
μ Ц мол€рна маса (кг/моль)
≥ Ц число ступен≥в в≥льност≥
R Ц ун≥версальна газова стала (ƒж/моль× )
Δ“ Ц зм≥на температури ( )
|
| «м≥на внутр≥шньоњ енерг≥њ | ΔU  × × 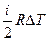
| |
| –обота при ≥зобаричному процес≥ | A= pDV | |
| –обота при ≥зотерм≥чному процес≥ | ј = 
| |
| оеф≥ц≥Їнт корисноњ д≥њ тепловоњ машини | 
| Q1 Ц теплота, передана робочому т≥лу (ƒж) Q2 Ц теплота, в≥ддана холодильнику (ƒж) |
| оеф≥ц≥Їнт корисноњ д≥њ ≥деального циклу арно | 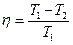
| “1 Ц температура нагр≥вника ( ) “2 Ц температура холодильника ( ) |
| оеф≥ц≥Їнт поверхневого нат€гу р≥дини | d =  d =
d = 
| d Ц коеф≥ц≥Їнт поверхневого нат€гу (Ќ/м) F Ц сила поверхневого нат€гу (Ќ) Δl Ц довжина контуру р≥дини (м) ј Ц робота (ƒж) DS Ц площа поверхн≥ р≥дини (м2) |
| ‘ормула Ћапласа (додатковий тиск, €кий викликаний кривизною поверхн≥ р≥дини) | р = d( ) )
| р Ц додатковий тиск, викликаний кривизною поверхн≥ р≥дини (ѕа)
 , ,  Ц рад≥уси кривизни двох взаЇмноперпендикул€рних перети-
н≥в поверхн≥ р≥дини (м) Ц рад≥уси кривизни двох взаЇмноперпендикул€рних перети-
н≥в поверхн≥ р≥дини (м)
|
| ‘ормула ∆юрена | h = 
| h Ц висота п≥дн€тт€ р≥дини у кап≥л€р≥ (м) r Ц рад≥ус кап≥л€ра (м) r Ц густина р≥дини (кг/м3) g Ц прискоренн€ в≥льного пад≥нн€ (м/с2) Q Ц краЇвий кут (при повному змочуванн≥ Q = 0, при повному незмочуванн≥ Q = p) |






