1.2.1.Механизм поглощения видимых
иультрафиолетовых лучей
По механизму взаимодействия с веществом видимые лучи близки прилежащей к ней ультрафиолетовой части спектра (табл. 1.1). Выделение видимой части спектра в самостоятель-
ную область обусловлено субъективными причинами - границами восприятия электромагнитного излучения человеческим глазом.
При поглощении видимых и ультрафиолетовых лучей изменяется энергетическое состояние электронных оболочек атомов и молекул. Спектры поглощения, полученные в этих областях, называются электронными.
Поглощение веществом электромагнитных колебаний в ультрафиолетовой и видимой области обусловлено переходом электронов со связующих орбиталей на разрыхляющие орбитали. Такое состояние молекулы называется возбужденным (обычно изображается *).
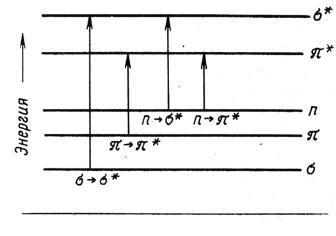
При взаимодействии с квантом света, поглощая энергию, электрон может переходить с высшей заполненной на низшую вакантную орбиталь. Электроны в атомах и молекулах занимают орбитали со строго определенной энергией. В обычных органических молекулах присутствуют электроны σ- иπ-связей,а также электроны неподеленных пар гетероатомов (O, N, S и т.д.) или n – электроны. Их относительные энергетические уровни и сравнительные энергии возможных переходов представлены на рис. 1.3.
Рис. 1.3. Схема электронных уровней и энергия возможных электронных переходов
Наибольшая энергия кванта необходима для осуществления перехода σ→σ*, т.е. для возбуждения электронов наиболее прочнойσ-связинеобходимы кванты света минимальной дли-
ны. Энергия переходов n→σ* иπ→π* меньше, и, следовательно, длина волны света, возбуждающего такой переход, соответственно больше. Практическое значение имеют переходыπ→π* и n→π*, поскольку только им соответствуют длины волн, попадающие в рабочий диапазон прибора.
Группировки, вызывающие избирательное поглощение электромагнитного колебания в видимой и ультрафиолетовой части спектра, называются хромофорами.
Основными хромофорами, дающими максимум поглощения в области 200 – 800 нм, являются системы сопряженных двойных связей. Сопряженные двойные связи будут поглощать кванты света с большей длиной волны, чем изолированные двойные связи. Для изолированных кратных связей в используемом для измерений интервале проявляется только переход карбонильной группы C = O (λmax = 270 нм). В ароматических системах переход электрона в возбужденное состояние осуществляется также при меньшей затрате энергии, чем в случае изолированной двойной связи.
Таким образом, основными хромофорами в УФспектроскопии являются сопряженные C=C-связи,карбонильная группа C=O, системыC=C-C=O,ароматическое ядро. Исключение составляют переходыπ→π* изолированных двойных
связей C=C и C=N-,а также тройных связей C≡C и C≡N ((λmax=650-180нм).
Спектры поглощения
Если плавно изменять длину волны падающего на вещество светового потока, то коэффициент ослабления вещества изменяется по довольно сложной зависимости.
Функция, связывающая коэффициент ослабления с длиной волны, называется спектром поглощения (абсорбции) вещества.
Спектрами называются также и другие оптические характеристики веществ: абсорбция вещества и светопропускание, вычерченные в зависимости от длины волны, частоты или волнового числа (рис. 1.4.).
Спектр поглощения удобен для качественного анализа и идентификации, и может претендовать на роль своеобразного паспорта вещества. Практически нет случаев, чтобы различные по химическому строению вещества имели полностью совпадающие спектры.
УФ-спектрорганического вещества характеристичен, т.к. поглощение определяется только собственно хромофором и его ближайшим окружением, т.е. один и тот же хромофор проявляется практически одинаково как в исключительно простых, так
исамых сложных молекулах.
Взависимости от непосредственного окружения одной и той же хромофорной группировки положение максимума поглощения в УФ-спектрахразличных соединений может несколько меняться. Введение в молекулу различных заместителей или изменение внешних условий, например растворителя, обычно вызывает сдвиг полосы поглощения. Сдвиг максимума в сторону более длинных волн принято называть батохромным сдвигом (обусловлен наличием атома галогена,гидрокси-,ами-но-,алкильных групп), а сдвиг в сторону более коротких волн – гипсохромным (например, образование водородной связи с растворителем).
| А | А | А |
Рис. 1.4. Некоторые способы изображения спектров поглощения
УФ-спектрв большинстве случаев представляет собой кривую с одним пологим максимумом (рис. 1.5.).
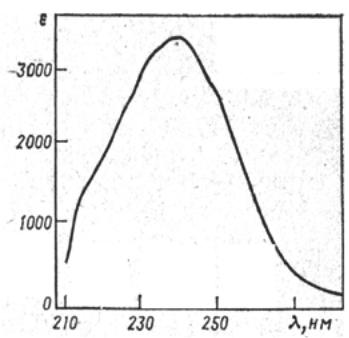
Рис. 1.5. УФ-спектрциклопентадиена
Уширение полос связано с сильным влиянием молекул растворителя на энергетические уровни электронов, ответственных за светопоглощение, и наложением колебательных переходов на электронный переход (помимо основных уровней электронных переходов существуют подуровни, связанные с колебаниями молекулы).
Обычно УФ-спектрхарактеризуют длиной волны, при которой наблюдается максимум поглощения, и молярным коэффициентом ослабления в этом максимуме. Например, спектр циклопентадиена (рис. 1.5.) достаточно точно может быть пе-
редан записью: λmax (в гексане) 240 нм (ε3400).УФ-спектрвещества может иметь несколько максимумов поглощения, каж-
дый из которых соответствует различным типам электронных переходов. В этом случае при цифровой записи спектра перечисляются длины волн максимумов поглощения и в скобках приводятся значения “ε”, соответствующие данному максимуму.
Молярный коэффициент ослабления для каждого поглощающего в УФ-областивещества при данной длине волны в одном растворителе имеет строго постоянное значение (издаются атласы спектров поглощения веществ, таблицы).
В качестве растворителей в УФ-спектроскопиииспользуются вещества, не имеющие поглощения в исследуемой области спектра и не реагирующие с растворенным веществом (гексан, гептан, циклогексан, спирты, вода, галогенопроизводные, простые эфиры, кислоты и др.).
Интенсивность поглощения в спектре связана с вероятностью данного типа электронного перехода. Наибольшей интенсивностью в спектрах поглощения обладают полосы, обусловленные переносом электрона от одного атома к другому (полосы переноса заряда). Более правильно следует говорить о переносе электрона между молекулярными орбиталями, локализованными у разных атомов. К ним относятся многие π→π*- иn→π*-переходы.Однако не все переходы осуществляются в действительности. Существуют так называемые правила отбора, определяющие разрешенные и запрещенные переходы. Эти правила учитывают в основном симметрию молекулы, а также симметрию основного и возбужденного состояний. Запрещены переходы, при которых происходит изменение спина электрона. Интенсивность поглощения, соответствующего разрешенным переходам, обычно более высока, молярный коэффициент ослабления достигает тысяч, а иногда и сотен тысяч единиц, тогда как для запрещенных переходов значение “ε” составляет десятки, реже – сотни единиц.
Устройство приборов
Приборы для селективного поглощения излучения растворами называются спекрофотометрами. При всем многообразии схем и конструктивных особенностей приборов абсорбционной спектроскопии в каждом из них имеется несколько основных узлов, функции которых примерно одинаковы в разных приборах. Такими узлами являются: источник света, монохроматор света, кювета с исследуемым веществом, приемник света.
В приборах абсорбционной спектроскопии свет от источника освещения проходит через монохроматор и падает на кювету с исследуемым веществом. Интенсивность монохромати-
ческого света, прошедшего через кювету, измеряется приемником света.
Ввидимой области источником света являются специальные лампы накаливания с вольфрамовой спиралью с высокой температурой нити, чтобы максимум испускания был смещен как можно дальше в видимую область. Такие лампы называют перекальными.
Вкачестве источника УФ-излученияобычно применяется водородная (дейтериевая) лампа: электрическая дуга в атмосфере водорода при низком давлении, которая дает практически непрерывный спектр излучения в области 200 – 400 нм. Кроме того, используют ртутные лампы. В ртутной лампе разряд происходит в парах ртути. Возбужденные атомы ртути испускают линейчатый спектр, в котором преобладает излучение
сдлиной волны 254, 302, 334 нм.
Монохроматоры и светофильтры предназначены для выделения из полихроматического спектра источника узкого участка, который в условиях опыта можно считать монохроматическим.
Светофильтры – это окрашенные стекла, пропускающие полосу 20 – 50 нм. Светофильтры применяют в колориметрах для выделения спектрального участка, в котором анализируемый раствор имеет наибольшую величину абсорбции (поглощения). Колориметры имеют набор светофильтров, непрерывно перекрывающих весь видимый участок спектра.
Плавное изменение длины волны светового потока возможно с помощью монохроматоров. Наибольшее распространение имеют призменные монохроматоры и монохроматоры с дифракционной решеткой.
Основным элементом призменного монохроматора является диспергирующая призма, которая разлагает полихроматическое излучение в спектр (рис. 1.6).
Излучение источника фокусируется конденсором на входной щели монохроматора. Входная щель установлена в фокусе коллиматорной линзы, направляющей параллельный пучок лучей на грань призмы. Диспергированные лучи фокусируются объективом в фокальной плоскости монохроматора, где нахо-
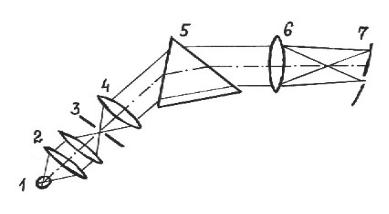
дится выходная щель, пропускающая только небольшую часть спектра. Для изменения длины волны выходящего из монохроматора потока излучения можно либо перемещать выходную щель в фокальной плоскости, либо поворачивать призму, последовательно фокусируя на неподвижную щель различные участки спектра. Существует много схем монохроматоров, отличающихся от изображенной на рис. 1.6.
Рис. 1.6. Устройство призменного монохроматора:
1 – источник излучения, 2 – конденсорные линзы, 3 – входная щель, 4 – коллиматорная линза, 5 – диспергирующая призма,
6 – объектив, 7 – фокальная плоскость
Монохроматическое излучение пропускается через кювету. Материал кюветы и призмы должен быть прозрачен во всем рабочем интервале длин волн монохроматора. В видимой области применяют призмы и кюветы из различных сортов (оптического) органического стекла, в ультрафиолетовой – кварц.
Приемником света в видимой и ультрафиолетовой областях является фотоэлемент, величина тока которого пропорциональна интенсивности падающего света. Ток усиливается и регистрируется потенциометром. Практически обычно определяют отношение интенсивностей монохроматического света, прошедшего через исследуемый раствор и через чистый растворитель или специально выбранный раствор сравнения.
Практическое применение
Электронные спектры поглощения для целей качественного анализа используются значительно реже, чем колебатель-

ные, так как они обычно бывают представлены небольшим числом широких полос поглощения, которые часто накладываются одна на другую и полностью или частично перекрываются. Однако по электронным спектрам поглощения иногда удается провести достаточно эффективный анализ качественного состава (см. раздел 1.2.2.): определить в исследуемых соединениях наличие или отсутствие группировки-хромофора,например в нефтехимии.
УФ-спектроскопиядает прекрасную возможность для количественного анализа веществ. Для этого записывают спектр поглощения анализируемого вещества при одной концентрации, выбирают максимум поглощения. Если в спектре имеется несколько полос, выбор обычно останавливается на наиболее интенсивной, так как работа в области максимума светопоглощения обеспечивает наиболее высокую чувствительность определения. Далее делают несколько разведений и при выбранном одном максимуме поглощения снимают значения абсорбции вещества. Строят калибровочную кривую, затем измеряют величину “A” анализируемого раствора и по графику определяют неизвестную концентрацию (рис. 1.7.).






