Тема 1: СТРОЕНИЕ РАСТИТЕЛЬНОЙ КЛЕТКИ
Цель занятия _____________________________________________________________
______________________
Работа 1. Изучение строения клетки внутренней эпидермы сочной чешуи лука репчатого – Allium cepa.
1й шаг. Приготовить временный препарат эпидермы сочной чешуи лука
Для этого луковицу лука разрезать пополам и высвободить одну из внутренних белых чешуек. С внутренней стороны чешуи при помощи иглы и пинцета снять кожицу, положить ее в каплю реактива Люголя на предметное стекло наружной стороной вверх. Расправить кожицу иголкой, накрыть покровным стеклом. Убрать остатки воды около покровного стекла с помощью фильтровальной бумаги.
2й шаг. Рассмотреть микропрепарат на малом и большом увеличении микроскопа.
Обратить внимание на форму клеток, найти ядро, цитоплазму, вакуоли. Клетки эпидермиса тонкостенные, вытянутые в длину, соединены плотно, без межклетников. На боковых стенках клеток иногда видны небольшие более тонкие места — поры, из-за которых стенка кажется прерывистой (четковидной). Прикрыв диафрагму, в более мелких клетках можно обнаружить тонкий постенный слой цитоплазмы. От него, пересекая вакуоль, отходят тяжи цитоплазмы, кажущиеся зернистыми от мелких включений. В средней части клетки или около одной из ее стенок тяжи соединяются в ядерный кармашек, окружающий ядро. В ядре нередко можно обнаружить одно или несколько мелких ядрышек, сильно преломляющих свет. Обычно в клетках хорошо видно струйчатое движение цитоплазмы.
3й шаг. Схематично изобразить клетку. Обозначить на рисунке ее структурные элементы.
|
Работа 2. Установить функции хлоропластов листа валлиснерии и движение цитоплазмы.
1й шаг. Из чашки Петри взять часть листа валлиснерии и приготовить временный микропрепарат. Сделать горизонтальный срез листа, положить его на предметное стекло в каплю воды. Накрыть покровным стеклом и рассмотреть под малым увеличением микроскопа.
2й шаг. Изучить форму клеток листа валлиснерии и хлоропластов. Обратить внимание на мелкие крупинки в хлоропластах - это первичный крахмал. Отыскать клетку, в которой хлоропласты двигаются, и рассмотреть ее под большим увеличением микроскопа. Сосредоточить внимание на одном хлоропласте и по его движению определить направление движения цитоплазмы. Если в клетке одна большая вакуоль, то цитоплазма двигается вокруг ее стенок (вращательное движение). Если в клетке несколько мелких вакуолей, то тяжи цитоплазмы соединяются возле ядра и можно увидеть струйчатое движение.
3й шаг. На рисунке 1.2. обозначить клеточную оболочку, цитоплазму, вакуоль, хлоропласты (закрасить зеленым цветом). Сделать выводы, где указать функцию хлоропластов.
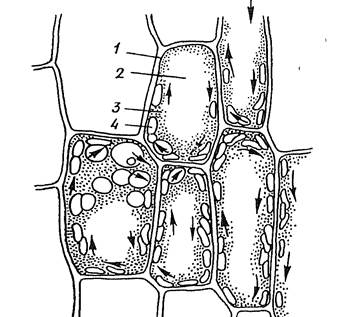
1________________________________
2_______________________________
3________________________________
4________________________________
Рис. 1.2.Клетки листа валлиснерии
Выводы__________________________________________________________________
__________
__________
Работа 3. Установить функции хромопластов из мякоти плодов шиповника (рябины, томатов).
1й шаг. Приготовить микропрепарат из плодов шиповника. Надрезать или надорвать кожицу плода и из-под нее препаровальной иглой набрать мякоти. Положить на предметное стекло в каплю воды, размешать и накрыть покровным стеклом. Препараты из мякоти плодов рябины и томата готовятся также.
2й шаг. Под малым увеличением микроскопа найти отдельные, свободно размещенные клетки, а под большим - рассмотреть их форму и хромопласты в
них. Обратить внимание на окраску и форму хромопластов, т.к. это является диагностическим признаком.
3й шаг. Сделать обозначения к рисунку 1.3. и вывод. В выводе указать функцию хромопластов.
|
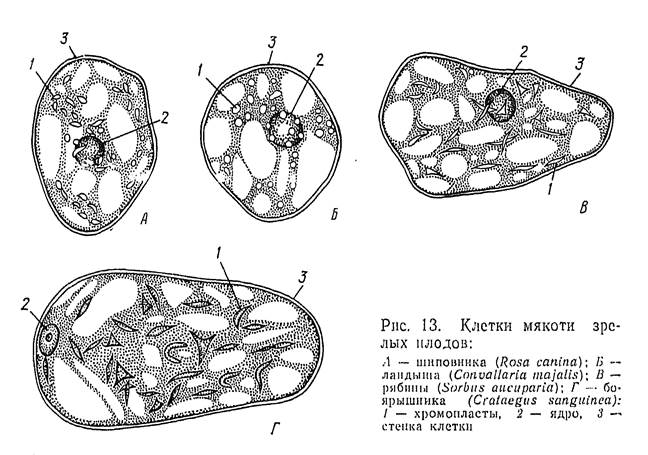
Рис. 1.3. Клетки с хромопластами
Выводы__________________________________________________________________
__________
__________
Работа 4. Установить функции лейкопластов эпидермы с поверхности листа традесканции.
1й шаг. Изготовить микропрепарат эпидермы листа традесканции. С нижней стороны листа традесканции снять с помощью иглы эпидерму и поместить ее на предметное стекло в каплю раствора сахарозы. Расправить иглой, накрыть стекло и рассмотреть под малым увеличением микроскопа. (Лейкопласты можно рассматривать в клетках мякоти дыни, помещенных в собственный сок).
2й шаг. Найти клетки с ядром, которое окружено мелкими бесцветными шариками - лейкопластами. Рассмотреть лейкопласты под большим увеличением микроскопа.
3й шаг. Сделать обозначения к рисунку 1.4. и вывод. Сделать вывод о связи цвета лейкопластов с содержащимися в них веществами.
|
Рис.1.4. Клетки листа традесканции.
Выводы__________________________________________________________________
__________
__________
_____
Работа 5. Изучить явление плазмолиза и деплазмолиза в клетках валлиснерии.
1й шаг. Из чашки Петри взять часть листа валлиснерии и приготовить временный микропрепарат. Сделать горизонтальный срез листа, положить его на предметное стекло в каплю воды. Накрыть покровным стеклом и рассмотреть под малым увеличением микроскопа распределение хлоропластов в клетке.
|
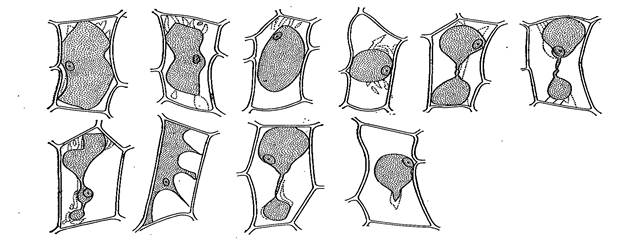
Рис. 1.5. Плазмолиз
2й шаг. Снять препарат со столика микроскопа, заменить воду под покровным стеклом на 6 %- ный раствор NaCl. Для этого нужно, не снимая покровное стекло, нанести каплю раствора около него так, чтобы она слилась с водой под стеклом, а затем с противоположной стороны «вытянуть» воду из-под стекла фильтровальной бумагой.
3й шаг. При малом увеличении микроскопа наблюдать процесс плазмолиза.
4й шаг. Проследить за процессом деплазмолиза клетки (восстановление тургора), заменив аналогичным образом раствор под покровным стеклом на воду. Обозначить на рисунке 1.5. оболочку, протопласт и полость клетки. В выводе объяснить явления плазмолиза и деплазмолиза.
Выводы__________________________________________________________________
__________
__________
_____
Тема 2: ЗАПАСНЫЕ И ЭКСКРЕТОРНЫЕ ВКЛЮЧЕНИЯ КЛЕТКИ
Цель занятия _____________________________________________________________
______________________
Работа 1. Вторичный крахмал запасающих органов картофеля – Solanum tuberosum и овса посевного – Avena sativa.
1й шаг. Разрезать клубень картофеля. С поверхности среза иглой соскоблить немного мутноватой массы (можно кусочком клубня несколько раз провести по капле) перенести ее на предметное стекло в каплю воды и накрыть покровным стеклом.
2й шаг. Под микроскопом при малом увеличении найти, а при большом – рассмотреть крупное простое зерно, сложные и полусложные зерна крахмала.
3й шаг. Рядом с покровным стеклом, не поднимая его, нанести каплю раствора Люголя (содержит йод), а при малом увеличении проследить возникновение цветной реакции.
Запомнить! Раствор Люголя, является специфическим реактивом на крахмал. При его действии крахмальные зерна окрашиваются в синий цвет.
4й шаг. Разрезать скальпелем набухшее в воде зерно овса, поверхностью среза коснуться капли воды на предметном стекле и накрыть покровным стеклом.
5й шаг. При малом увеличении микроскопа рассмотреть крупные зерна крахмала, при большом – изучить их строение. Провести цветную реакцию на крахмал овса.
6й шаг. Найти на рисунке 2.1. крахмальные зерна овса и картофеля, указать номер, их тип, концентричность слоев крахмала и образовательный центр. Найти и указать номера простых, сложных и полусложных зерен крахмала. Сделать вывод о видоспецифичности строения и формы крахмальных зерен.
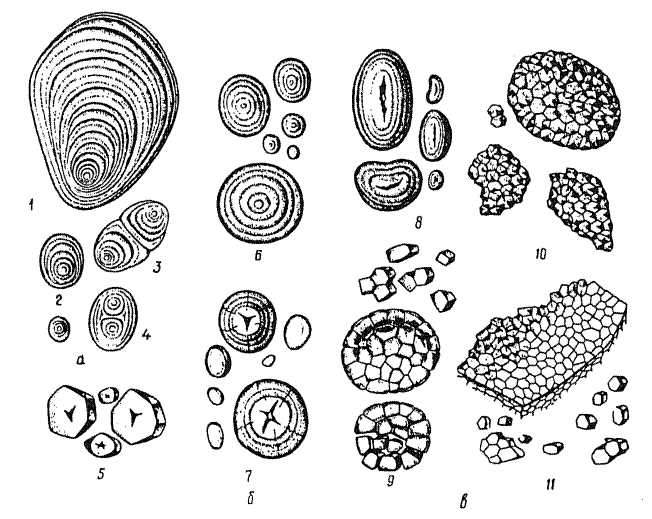
Рис. 2.1. Виды крахмальных зерен.
Крахмальные зерна картофеля ______________________________________________
___________
___________
Крахмальные зерна овса_________________________________________________
_____Простые ______________________________________________________________
Сложные_____________________________________________________________Полусложные_________________________________________________________
Выводы__________________________________________________________________
__________
__________
Работа 2. Обнаружить алейроновые зерна и жирные масла в клетках семян клещевины обыкновенной – Ricinus communis.
1й шаг. Сделать тонкий поперечный срез через среднюю часть семени клещевины. Перенести срез на предметное стекло и рассмотреть его на малом и большом увеличении. Найти алейроновые зерна и капли жирного масла.
2й шаг. Снять покровное стекло и обработать срез Суданом Ш. Рассмотреть срез при малом и большом увеличении микроскопа. Судан Ш окрашивает капли жирных масел в розово-оранжевый цвет, но не действует на алейроновые зерна (остаются неокрашенными).
3й шаг. Привести обозначения к рисунку 2.2., отметив в алейроновых зернах белковую оболочку, аморфный белок, кристаллический белок (кристаллоид), глобоид (кальций-магниевая соль инозитгексафосфорной кислоты).
4й шаг. Сделать вывод о диагностическом значении строения и формы алейроновых зерен и указать особенности действия Судан Ш на жирные масла.

|
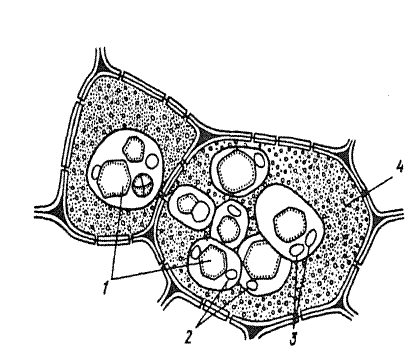
Рис. 2.2. Клетки семян клещевины.
Выводы__________________________________________________________________
__________
______________________
___________
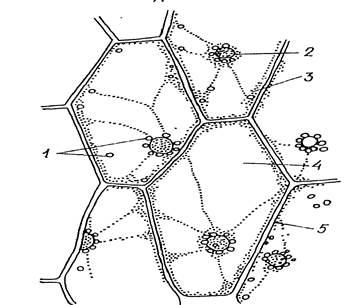
Работа 3. Установить форму экскреторных включений (кристаллы щавелевокислого кальция) в клетках сухой чешуи луковицы лука репчатого – Allium cepa и плодах шиповника собачьего – Rosa canina.
1й шаг. Кусочек тонкой светло-коричневой чешуи лука поместить на предметное стекло в каплю воды, расправить иглой и накрыть покровным стеклом.
2й шаг. Препарат рассмотреть на малом и большом увеличении микроскопа. В клетках найти одиночные призматические кристаллы.
3й шаг. Зарисовать несколько клеток с отдельными кристаллами, поставить обозначения.
4й шаг. Надрезать или надорвать кожицу плода шиповника (рябины) и из-под нее препаровальной иглой набрать мякоти. Положить на предметное стекло в каплю воды, размешать и накрыть покровным стеклом.
5й шаг. Рассмотреть на малом и большом увеличении микроскопа. Найти клетки с друзами (звездчатыми кристаллами). Обратить внимание на то, что в клетке находится только одна друза.
6й шаг. Зарисовать несколько клеток паренхимной формы с друзами, обозначив их на рисунке. Сделать вывод о видоспецифичности кристаллов оксалата кальция.
|
Выводы__________________________________________________________________
__________
______________________
___________
Тема 3: КЛЕТОЧНАЯ ОБОЛОЧКА И ЕЕ ВТОРИЧНЫЕ ИЗМЕНЕНИЯ. СТРОЕНИЕ ЦИСТОЛИТА.
Цель занятия _____________________________________________________________
______________________
Работа 1. Изучить строение оболочки клеток кожицы листа аспидистры – Aspidistra elatior.
1й шаг. Небольшой кусочек листа аспидистры положить на бумагу верхней стороной наружу. Аккуратно и тщательно соскоблить с него все верхние ткани, чтобы остались только нижняя прозрачная кожица – эпидермис. Лезвием отделить от листа участок кожицы, поместить его на предметное стекло в каплю воды и накрыть покровным стеклом. 2й шаг. Под микроскопом при малом увеличении найти на срезе место, где клетки располагаются в один слой; при большом увеличении – изучить боковые стенки клеток.
В месте контакта двух клеток видна сплошная темная линия. Это срединная пластинка и примыкающие к ней с обеих сторон клеток первичные оболочки. От темной линии в полость клетки откладывается вторичная оболочка, в которой располагаются каналы пор. Они похожи на небольшие округлые образования. Поры соседних клеток стыкуются друг с другом и разделяются лишь замыкающей пленкой.
3й шаг. Обозначить на рисунке 3.1. срединную пластинку, первичную и вторичную оболочки, поры. Сделать вывод, в котором указать вид пор в клетках кожицы аспидистры.
|
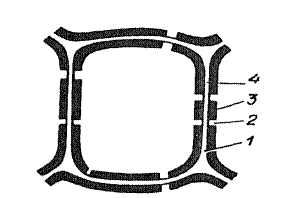
Рис.3.1. Оболочка растительной клетки.
Выводы__________________________________________________________________
__________
___________
Работа 2. Микроструктура каменистых клеток (склереид) мякоти плода груши.
1й шаг. Тонкие срезы из мякоти груши (спиртовой или живой материал) поместить на предметное стекло в каплю воды и накрыть покровным стеклом. При большом увеличении микроскопа рассмотреть склереиды, которые отличаются значительным утолщением клеточных оболочек, пронизанных множеством щелевидных поровых канальцев. Клетки мертвы, лишены живого содержимого. В местах соприкосновения клеток канальцы совпадают, разделяясь лишь тонкой первичной оболочкой
2й шаг. Зарисовать одну клетку при большом увеличении микроскопа. Обозначить стенку клетки, ее пустоты и поры.
 3й шаг. Сделать вывод. Кратко отметить отличие простых пор от окаймленных, и указать, для каких клеток характерны окаймленные поры.
3й шаг. Сделать вывод. Кратко отметить отличие простых пор от окаймленных, и указать, для каких клеток характерны окаймленные поры.
Выводы _____________________________________________________________
_____
_____
Работа 3. Характеристика химического состава клеточной оболочки и ее вторичных изменений.
1й шаг. Взять две чашки Петри. В одну положить небольшой кусочек ваты и газетной бумаги, в другую - сосновую лучинку и свежий срез бутылочной пробки.
2й шаг. На кусочки ваты и газетной бумаги подействовать хлор-цинк-йодом. Результаты реакции записать в таблицу.
3й шаг. С помощью стеклянной палочки нанести на сосновую лучинку вначале флороглюцин, а затем концентрированную соляную кислоту. На свежий срез бутылочной пробки подействовать Суданом Ш. Результаты реакции записать в таблицу.
4й шаг. Дополнить таблицу необходимой информацией.
Таблица 3.2. Характеристика клеточной оболочки и ее вторичных изменений
| Исходное состояние и вторичные изменения | Вещества, процессы, вызывающие вторичные изменения | Свойства оболочки | Клетки живые/ мертвые | Качественные реакции и их результаты | |
| Реактивы | Видимые изменения | ||||
| Целлюлозная оболочка | прочная, эластичная | живые | хлор-цинк-йод | синий или фиолетовый цвет | |
| Одревеснение - лигнифика-ция | . | . | |||
| Опробковение - субериниза-ция | |||||
| Кутинизация | |||||
| Минерализа-ция | |||||
| Ослизнение |
Работа 4. Изучить строение цистолита – внутреннего выроста клеточной оболочки.
1й шаг. Кусочек листа крапивы прокипятить 2-3 мин. в небольшом количестве щелочи, несколько раз промыть дистиллированной водой и рассмотреть под микроскопом при малом и большом увеличении.
2й шаг. На рисунке 3.3. обозначить ножку цистолита, состоящую из целлюлозы и тело, образованное кристаллогидратами карбоната кальция.
|
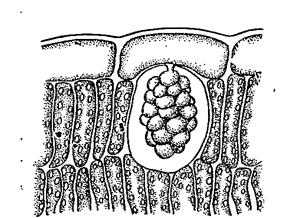
Рис. 3.3. Цистолит листа инжира.
3й шаг. Сделать вывод о диагностическом значении формы и размера цистолита.
Выводы______________________________________________________________
_____
_____
Тема 4: ПОКРОВНЫЕ ТКАНИ РАСТЕНИЙ
Цель занятия ________________________________________________________
__________
Работа 1. Изучить строение первичной покровной ткани на временном препарате.
1й шаг. Приготовить препараты нижней поверхности живого листа однодольного (ирис, кукуруза или ландыш) и двудольного растений (герань или смородина). Снять пинцетом кусочек эпидермиса, положить его в каплю воды, и накрыть покровным стеклом. Рассмотреть препараты при малом и большом увеличении микроскопа.
2й шаг. Обратить внимание на: а) форму основных эпидермальных клеток; б) наличие устьиц в эпидермисе в) форму замыкающих клеток устьиц; г) наличие сопровождающих клеток; д) тип устьичного аппарата; е) наличие эпидермальных волосков, их тип, строение.
3й шаг. Оформить результаты в виде таблицы 1.
4й шаг. Сделать вывод, указав различия в строении эпидермиса однодольных и двудольных растений.
Таблица 4.1. Эпидермальные структуры двудольных и однодольных растений.
| Структурные признаки | Растения | |
| Двудольное - | Однодольное - | |
| 1. Форма основных эпидермальных клеток. | ||
| 2. Степень извилистости оболочек | ||
| 3. Форма замыкающих клеток. | ||
| 4. Форма побочных клеток. | ||
| 5. Тип устьичного аппарата. | ||
| 6. Наличие трихом и их тип. |
Выводы______________________________________________________________
_____
_____
Работа 2. Установить строение и функции пробковой (вторичной) ткани клубня картофеля – Solanum tuberosum.
1й шаг. Приготовить микропрепарат поперечного среза клубня картофеля. Для этого сделать несколько поперечных срезов, отмыть их в чашке Петри с дистиллированной водой, выбрать тончайший, положить на предметное стекло в каплю воды и накрыть покровным стеклышком.
2й шаг. Рассмотреть срез на малом и большом увеличении микроскопа. Параллельно рассмотреть рисунок на микрофотографии. Снаружи видны остатки эпидермы, за ней расположены правильные радиальные ряды мертвой вторичной покровной ткани - пробки (феллемы) с толстыми оболочками (окрашиваются Суданом III в оранжевый цвет). Под пробкой размещается пласт живых тонкостенных клеток с цитоплазмой (феллоген - пробковый камбий), разделенных тангентально на две половины. Под феллогеном размещается образованная им живая паренхимная ткань - феллодерма - с крахмалом.
3й шаг. Зарисовать часть среза. Обозначить ткани клубня картофеля.
|
Работа 3. Оценка строения перидермы стебля бузины (сливы, дуба обыкновенного).
1й шаг. С поперечного разреза 1 – 2-летних веток одного из указанных растений сделать тонкий срез, поместить его на предметное стекло в каплю воды, накрыть покровным стеклом и рассмотреть под микроскопом при малом и большом увеличении.
2й шаг. На срезе снаружи найти полуразрушенные, плоские клетки эпидермиса, за ними – правильные радиальные ряды пробки (феллемы) с толстыми оболочками, без протопластов. Иногда во внутренних клетках пробки заметны не успевшие разрушиться ядра. Под пробкой располагается слой живых тонкостенных клеток с густой цитоплазмой. Это феллоген. Внутрь от него лежит образованная им живая паренхимная ткань – феллодерма. Феллема, феллоген и феллодерма составляют перидерму (В).
3й шаг. По результатам заданий 1-2 заполните таблицу 2.
4й шаг. Рассмотреть строение чечевички (А). На разрезе видно, что она по очертанию двояковыпуклая, почти заполнена рыхло располагающимися округлыми клетками – выполняющей тканью. Верхний слой – более плотный, с рядом разрывов, трещин – состоит из клеток пробки. К феллогену примыкает несколько слоев недифференцированных тканей.
5й шаг. Привести обозначения к рис.4.3. Сделать вывод о значении чечевичек при идентификации лекарственного растительного сырья.

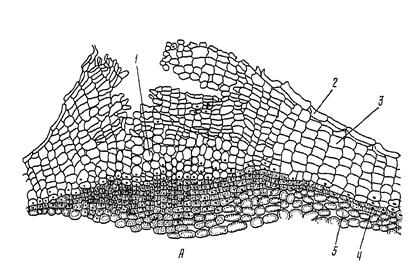

В
Рис. 4.3. Строение перидермы стебля бузины
Таблица 4.3. Характеристика составных частей перидермы.
| Составные части перидермы | Функции | Морфогенетические признаки | ||||
| первичная/ вторичная | живая/ мертвая | плотная/ рыхлая | бесцветная/ окрашенная | характер клеточной стенки | ||
| феллоген | ||||||
| пробка | ||||||
| феллодерма |
Выводы______________________________________________________________
_____
_____
_____
Тема 5: СЕКРЕТОРНЫЕ ТКАНИ РАСТЕНИЙ
Цель занятия ________________________________________________________
__________






