Лекция 3. СТРОЕНИЕ АТОМА.
Явления, подтверждающие сложное строение атома.
Первоначально высказанная в виде догадки идея об атомном строении вещества по мере развития науки подтверждалась все большим числом опытов и в XIX веке превратилась в общепризнанную теорию. Вплоть до конца XIX века атомы считались вечными неизменными и неделимыми частицами материи, не имеющими внутренней структуры. Однако во второй половине XIX века было обнаружено много таких явлений, которые ставили под сомнение предположение об отсутствии внутренней структуры у атомов. Перечислим основные:
1. Электризация – электрические заряды, как положительные, так и отрицательные, должны входить в состав атомов.
2. Исследование оптических спектров химических элементов – атомы каждого химического элемента дают свое собственное излучение. Из электромагнитной теории света следует, что излучение атомов имеет электромагнитную природу, т.е. должно создаваться тем или иным движением зарядов, входящих в состав атома.
3. Открытая Менделеевым в 1869 г. периодичность свойств химических элементов свидетельствовала о повторяющихся комбинациях электрических зарядов внутри атомов.
4. Законы электролиза, установленные Фарадеем.
5. При опытах с рентгеновскими лучами и по фотоэффекту были обнаружены отрицательные и абсолютно одинаковые частицы, названные в 1891 г. электронами.
6. Открытие Беккерелем в 1896 г. излучения, источником которого являлись урановые руды и природа которого была не ясна. Последующие исследования П. и М. Кюри, Резерфорда показали, что это излучение имеет сложный характер и может быть разделено на лучи трех видов - α, β, γ. α – лучи оказались состоящими из дважды ионизированных атомов гелия, получивших название α-частиц, β-лучи - потоком быстрых электронов (β-частицы), γ-лучи - очень короткими электромагнитными волнами.
Спектральные закономерности.
Изучение атомных спектров послужило ключом к познанию строения атома. Излучение невзаимодействующих атомов состоит из отдельных спектральных линий. Такой спектр испускания атомов называется линейчатым. Было замечено, что линии в спектре расположены не беспорядочно, а объединяются в группы или, как их называют, в серии. Линии располагаются в определенном порядке. Расстояние между ними закономерно убывает по мере перехода от более длинных волн к более коротким.
В 1885 г. Бальмер обнаружил, что длины волн, соответствующие линиям видимой части спектра атома водорода, могут быть точно представлены в виде

где R = 1,097∙ 107 м-1 – константа, получившая название постоянной Ридберга, работы которого были известны в области спектроскопии. Эта формула получила название формулы Бальмера, а соответствующая серия спектральных линий – серией Бальмера.
Дальнейшие опыты показали, что открытые позже линии водорода, лежащие в ультрафиолетовой (серия Лаймана) и в инфракрасной областях (серия Пашена), укладываются в аналогичные формулы. Обобщенная формула Бальмера включает все линии водородного спектра
 ,
,
где n = 1, 2, 3, …, причем m > n. Число n определяет серию: n = 1 – серия Лаймана, n = 2 – серия Бальмера, n = 3 - серия Пашена и т. д.
Установленные сериальные закономерности, универсальность постоянной Ридберга свидетельствовали о глубоком физическом смысле открытых законов. Трудно было себе представить возможность излучения целого ряда частот таким простым атомом, как атом водорода.
Модель атома Томпсона
Для объяснения линейчатого спектра, испускаемого изолированным атомом, следовало бы предположить, что электрон в излучающем атоме совершает гармонические колебания, которые согласно классическим законам, и обусловливают монохроматическое излучение. Поэтому на основании вида атомных спектров следовало бы предположить такое устройство атома, при котором электроны, входящие в его состав, способны совершать гармонические колебания, т.е. удерживаться около положения равновесия квазиупругой силой вида F= - kr, где r – отклонение электрона от положения равновесия.
Первая модель строения атома была предложена Томсоном в 1903 г. Согласно этой модели, атом представляет собой равномерно заряженную положительным электричеством сферу, внутри которой находится электрон. Если заряд электрона равен положительному заряду сферы, то такой атом будет нейтральным, а сила, действующая на электрон при его смещении, подчиняется закону квазиупругой силы. Однако для объяснения спектральных закономерностей модель Томсона оказалась совершенно непригодной. Более того, исходные соображения Томсона относительно характера распределения положительных и отрицательных зарядов в атоме не опирались на какие-либо экспериментальные факты.
Недостатки модели: не подтверждена экспериментальными фактами, не объясняла спектральных закономерностей.
Модель атома Резерфорда
Важнейшим шагом вперед явилась попытка непосредственного опытного зондирования внутренних областей атома с целью установления пространственного распределения зарядов в атоме. Такое зондирование осуществил Резерфорд с помощью α – частиц, наблюдая изменение направления их полета (рассеяние) при прохождении через тонкие слои вещества.
Опыты Резерфорда показали, что наряду со случаями отклонения α – частиц на малые углы довольно часто происходят столкновения, вызывающие отклонения на углы вплоть до 180˚. Проанализировав результаты опыта, Резерфорд пришел к выводу, что столь сильное отклонение α – частиц возможно только в случае, если внутри атома имеется чрезвычайно сильное электрическое поле. Это поле создается зарядом, связанным с большой массой и сконцентрированным в очень маленьком объеме.
Основываясь на этом выводе, Резерфорд предложил в 1911 г. ядерную модель атома: атом представляет собой систему зарядов, в центре которой расположено тяжелое положительное ядро с зарядом Ze, имеющее размеры, не превышающие 10-14 м. Вокруг ядра в области с линейными размерами порядка 10-10 м расположены Z электронов, распределенных по всему объему, занимаемому атомом. Почти вся масса атома сосредоточена в ядре. Созданная Резерфордом модель напоминала строение солнечной системы, где вокруг массивного Солнца движутся сравнительно легкие планеты, поэтому такую модель строения атома назвали планетарной.
Итак, результаты опытов по рассеянию α – частиц свидетельствуют в пользу ядерной модели Резерфорда. Однако ядерная модель оказалась в противоречии с законами классической механики и электродинамики. Поскольку система неподвижных зарядов не может находиться в устойчивом состоянии – под действием кулоновских сил электроны сразу упали бы на ядро, Резерфорду пришлось отказаться от статической модели атома и предположить, что электроны движутся вокруг ядра, описывая искривленные траектории. Но в этом случае электрон будет двигаться с ускорением, непрерывно излучая электромагнитные волны, согласно классической электродинамике. Процесс излучения сопровождается потерей энергии, так что, в конечном счете, электрон должен упасть на ядро. Такая модель также не объясняла спектральных закономерностей. Электрон, приближаясь к ядру должен двигаться все быстрее, порождая все более короткие электромагнитные волны, в этом случае спектр излучения должен быть сплошным.
Недостатки модели: непрерывная потеря электроном энергии в виде излучения электромагнитных волн; неустойчивость атома; сплошной спектр излучения. В действительности: атом – устойчивая система; излучение имеет линейчатый спектр.
Для объяснения этих противоречий можно было выдвинуть два предположения: либо считать, что предложенная Резерфордом ядерная модель атома не соответствует действительности, либо считать, что законы классической физики имеют ограниченное значение и не могут применяться к движению таких маленьких частиц материи, как электрон.
Заменить ядерную модель атома другой моделью, которая соответствовала бы опытам Резерфорда и не противоречила бы классической физике, не удалось.
Постулаты Бора
Выход из затруднения был предложен Бором. Опираясь на идеи квантовой теории Планка, Бор предположил, что и в случае атома Резерфорда непрерывное излучение, требуемое классической электродинамикой, невозможно. Для истолкования линейчатых спектров Бор предположил, что излучение обладает частотой, определяемой из следующего условия
 ,
,
где En и Em – энергии системы до и после излучения.
Исходя из этого закона, можно заключить, что спектры не дают нам картины движения частиц в атоме, как принимается в классической теории излучения, а позволяют судить лишь об изменениях энергии при различных возможных процессах в атоме. Дискретный характер спектральных линий свидетельствует о существовании определенных, дискретных значениях энергии, соответствующих особым состояниям атома. Эти состояния Бор назвал стационарными, ибо предположил, что атом может пребывать в каждом из них определенное время и, покидая его, снова попадает в другое стационарное состояние, изменяя свою энергию на конечную величину.
В 1913 г. Бор сформулировал два постулата:
1. Первый постулат (постулат стационарных состояний) - существуют стационарные состояния атома, находясь в которых он не излучает энергию. Этим стационарным состояниям соответствуют определенные (стационарные) орбиты, по которым движутся электроны.
Правило квантования орбит – из всех орбит электрона, возможных с точки зрения классической механики, осуществляются только те, для которых момент импульса равен величине, кратной постоянной Планка
 - целое число,
- целое число,
m – масса электрона, υ– скорость электрона, r – радиус орбиты.
2. Второй постулат (правило частот) – при переходе атома из одного стационарного состояния в другое испускается или поглощается один фотон
 .
.
Атом водорода
Рассмотрим электрон, движущийся в поле атомного ядра с зарядом Ze. При Z = 1 такая система соответствует атому водорода, при иных Z – водородоподобному атому, т.е. иону, имеющему порядковый номер Z в таблице Менделеева и один электрон. Согласно закону Кулона между двумя точечными зарядами будет действовать сила

По закону динамики

Используя правило квантования орбит и исключая скорость, получим для радиусов допустимых орбит

Радиус первой боровской орбиты атома водорода

Внутренняя энергия атома складывается из кинетической энергии электрона (ядро неподвижно) и энергии взаимодействия электрона с ядром – потенциальной энергии


Подставив сюда выражение для радиуса орбиты, получим
 , где n =1,2,3,… - главное квантовое число.
, где n =1,2,3,… - главное квантовое число.
Из формулы следует, что энергетические состояния атома водорода образуют последовательность энергетических уровней, изменяющихся в зависимости от числа n. Энергетическое состояние, соответствующее n = 1, называется основным или невозбужденным состоянием. Все состояния n >1 называются возбужденными.
При возрастании n энергетические уровни сближаются к границе, соответствующей n = ∞. При этом энергия электрона в атоме равна нулю. Знак минус в формуле показывает, что электрон связан в атоме силой притяжения к ядру. Абсолютное значение энергии является энергией связи электрона в атоме, находящимся в состоянии n. Значение энергии связи En = 0 соответствует ионизации атома, т.е. отрыву от него электрона. Для основного состояния энергия ионизации атома водорода равна 13,6 эВ.
При переходе атома водорода из состояния m в состояние n, m > n, излучается фотон, так как энергия Em > En по модулю

Переписав это соотношение для 1/λ, получим обобщенную формулу Бальмера
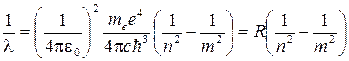 ,
,
Здесь постоянная Ридберга определяется подстановкой численных значений универсальных физических констант и поразительно совпадает с известным из опытов значением этой постоянной. На рисунке приведена схема энергетических уровней атома водорода. Стрелками укажем переходы, соответствующие излучению различных спектральных серий.

Постулаты Бора о существовании стационарных состояний атомов и правило частот нашли свое экспериментальное подтверждение в опытах Франка и Герца в 1913 г.
В опытах изучались столкновения электронов с атомами. Первые опыты были поставлены на парах ртути. Электроны, встречающие на своем пути атомы ртути испытывали с ними соударения двух видов. При упругих столкновениях энергия электронов не изменялась, а изменялось лишь направление их движения. Это, хотя и затрудняло попадание электронов на анод, однако не могло служить причиной полного отсутствия анодного тока, который возрастал с увеличением разности потенциалов. При неупругих столкновениях электрон терял свою энергию, передавая ее атому ртути. В соответствии с постулатами Бора атом не может принять энергию в любом количестве, а лишь определенную порцию, переходя при этом в возбужденное состояние. Ближайшим к основному состоянию атома ртути является возбужденное состояние, отстоящее от основного по шкале энергий на 4,86 эВ. Таким образом, при напряжении 4,86 В должно происходить резкое падение анодного тока, что и наблюдалось в эксперименте. Аналогичная ситуация должна повторяться при напряжениях, кратных 4,86 эВ. Правило частот также подтвердилось на эксперименте. Ртутные пары переходя из возбужденного состояния в основное излучали ультрафиолетовые волны с длиной волны, соответствующей первой резонансной линии в спектре ртути.
Теория Бора сыграла важную роль в создании атомной физики. Особенно велика ее роль в развитии атомной спектроскопии, где огромный экспериментальный материал с помощью теории Бора был систематизирован и сведен к определенным полуэмпирическим закономерностям.
Однако наряду с определенными успехами в теории Бора с самого начала обнаружились существенные недостатки. Теория была внутренне противоречива. Основываясь на механическом соединении классической физики с квантовыми постулатами, теория Бора в ряде проблем привела к существенным трудностям. Наиболее серьезной неудачей в теории Бора явилась абсолютная невозможность с ее помощью создать теорию атома гелия, содержащего помимо ядра два электрона. Постепенно становилось очевидным, что теория Бора представляла собой лишь переходный этап на пути создания последовательной теории атомных и ядерных явлений. Такой последовательной теорией явилась квантовая (волновая) механика.






