«на€ плотность раствора, можно легко установить взаимосв€зь между различными способами выражени€ его концентрации. ƒл€ этого необходимо решить в общем виде систему уравнений, состо€щую из формул, выражающих его концентрации. Ќапример:


 .
.
ќтсюда:
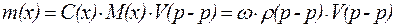 ,
,
— учетом размерности объЄма:
 . .
| (41) |
јналогично:
 . .
| (42) |
 . .
| (43) |
¬ некоторых случа€х знать плотность раствора не требуетс€:
 . .
| (44) |
 . .
| (45) |
ѕримеры решени€ задач
«адача є1
0,585 г NaCl растворили в мерной колбе на 100 мл. ѕлотность полученного раствора оказалась равна 1,05 г/мл. –ассчитать:
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
–ешение.
1) 
2) 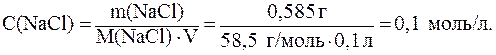
3) 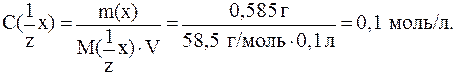
ƒругой способ: так как дл€ NaCl  = 1, то
= 1, то  = C(NaCl) =
= C(NaCl) =
= 0,1 моль/л.
4) m(р-р) = rЈV = 1,05 г/мл Ј 100 мл = 105 г.
m(H2O) = m(р-р) - m(NaCl) = 105 г - 0,585 г = 104,415 гї0,1044 кг.

“аким образом, в разбавленных растворах C(x)ї b(x).
5) 
6) 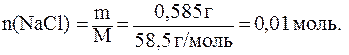


«адача є2
“ребуетс€ приготовить:
1) 200 мл раствора NaHCO3 с C(NaHCO3) = 0,1 моль/л.
2) 500 мл 10% раствора K2CO3 плотностью 1,15 г/мл.
–ешение.
„тобы приготовить раствор заданного объЄма и заданной концентрации необходимо рассчитать массу содержащегос€ в нем растворЄнного вещества.
1) 
“ехника приготовлени€ раствора:
а) взвесить на весах 1,68 г сухого NaHCO3;
б) через воронку перенести сухое вещество в мерную колбу вместимостью 200 мл;
в) добавить до метки на горлышке колбы дистиллированную воду.
2) 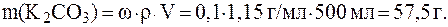
“ехника приготовлени€ раствора аналогична.
«адача є3
ѕриготовить 250 мл раствора CuSO4 с C( CuSO4) = 0,1 моль/л из кристаллогидрата CuSO4Ј5Ќ2ќ.
CuSO4) = 0,1 моль/л из кристаллогидрата CuSO4Ј5Ќ2ќ.
–ешение.
ƒанна€ задача сводитс€ к вычислению массы кристаллогидрата.
1) ЌайдЄм массу безводного CuSO4 в растворе:
m(CuSO4) = C( CuSO4)ЈM(
CuSO4)ЈM( CuSO4) V(р-р) =
CuSO4) V(р-р) =
= 0,1 моль/лЈ  Ј0,25 л = 2 г.
Ј0,25 л = 2 г.
2) ЌайдЄм массу кристаллогидрата, содержащего 2 г CuSO4, из закона стехиометрических соотношений:
n(CuSO4Ј5H2O) = n(CuSO4) = 
3) m(CuSO4Ј5H2O) = n(CuSO4Ј5H2O)ЈM(CuSO4Ј5H2O) =
= 0,0125 мольЈ250 г/моль = 3,12 г.
ѕриготовление раствора аналогично предыдущей задаче.
ѕри отсутствии сухого вещества раствор с заданной концентрацией можно приготовить разбавлением более концентрированного раствора. ¬ задачах такого типа необходимо учитывать, что масса растворЄнного вещества при разбавлении не измен€етс€.
«адача є4
¬ычислить массу воды, которую необходимо добавить к 200 г 2% раствора NaCl, чтобы получить раствор с w¢(NaCl) = 0,9%.
–ешение.
1) ¬ исходном растворе:
m(NaCl) = wЈm(р-р) = 0,02Ј200 г = 4 г.
2) ћасса раствора после разбавлени€:

3) m(H2O) = m(разб. р-р) - m(исх. р-р) = 444 г - 200 г = 244 г.
«адача є5
ѕриготовить 250 мл раствора H2SO4 с C(H2SO4) = 0,1 моль/л из 10% раствора H2SO4 плотностью 1,06 г/мл.
–ешение.
¬ данном случае необходимо рассчитать объЄм пробы концентрированного раствора.
|
|
|
1) найдем массу H2SO4 в заданном растворе:
m(H2SO4) = C(H2SO4)ЈM(H2SO4)ЈV(р-р) = 0,1Ј98Ј0,25 = 2,45 г.
2) найдем массу 10% раствора H2SO4, который содержит 2,45 г кислоты:

3) ќбъЄм 10% раствора H2SO4 равен:

ѕриготовление раствора:
а) отмерить мерным цилиндром 23 мл 10% раствора H2SO4;
б) перенести его в мерную колбу вместимостью 250 мл;
в) добавить до метки дистиллированную воду.
¬ некоторых случа€х разбавление €вл€етс€ единственным способом приготовлени€ раствора с заданными характеристиками. Ёто относитс€ к растворам газообразных или неустойчивых в чистом виде веществ (HCl, H2O2 и т. д.).
«адача є6
ƒл€ обработки ран, порезов, слизистой оболочки используют 3% раствор пероксида водорода. Ќайти максимальный объЄм 3% раствора H2O2 (rї 1 г/мл), который можно приготовить из 200 мл пергидрол€ (30% раствора H2O2 плотностью 1,1 г/мл).
–ешение.
«адачи на разбавление можно решать и в общем виде. ќбозначим данные исходного раствора индексом Ђ0ї. — учетом сохранени€ массы H2O2:
m(H2O2) = w0Јr0ЈV0 = wЈrЈV.
ќтсюда:

«адача є7
ѕриготовить 100 мл раствора Ќ—1 с C(HCl) = 0,1 моль/л из 5% раствора HCl плотностью 1,02 г/мл.
–ешение.
¬ данном случае мы имеем дело с различными видами концентрации раствора. ќднако здесь также можно воспользоватьс€ равенством массы HCl в пробе концентрированного раствора и в приготовленном растворе:
m(HCl) = w0Јr0ЈV0 = —ЈћЈV.
ѕри этом необходимо только учесть различие в размерности объЄма при использовании массовой доли и мол€рной концентрации:

ѕриготовление раствора аналогично задаче 5.
«адача є8
Ќайти мол€рную концентрацию эквивалента 10% раствора фосфорной кислоты плотностью 1,1 г/мл.
–ешение.
«десь удобно воспользоватьс€ формулой пересчета (42):
 .
.
ƒл€ Ќ3–ќ4  . —оответственно:
. —оответственно:
 .
.
“аким образом:

—итуационна€ задача
ѕри отравлении соединени€ми мышь€ка ввод€т унитиол из расчета 56 мг вещества на 10 кг массы человека. ¬ычислить объЄм 5% раствора унитиола плотностью 1,12 г/мл, который необходимо ввести пациенту массой 60 кг.
–ешение.
ћасса унитиола равна:

ќбъЄм раствора составл€ет:

¬опросы дл€ самоконтрол€
1. „то такое раствор? ѕриведите примеры растворов, наход€щихс€ в разном агрегатном состо€нии.
2. ¬ чем заключаетс€ отличие химической теории растворов от физической?
3. „то такое количество вещества?
4. „то называют мол€рной массой?
5. „то такое химический эквивалент?
6. „то такое фактор эквивалентности?
7. „то называют мол€рной массой эквивалента?
8. „то такое массова€ дол€ растворЄнного вещества? акова еЄ размерность?
9. „то такое мол€рна€ концентраци€? акова еЄ размерность?
10. „то такое мол€рна€ концентраци€ эквивалента? акова еЄ размерность?
11. „то такое мол€льна€ концентраци€? акова еЄ размерность?
12. „то такое титр раствора? акова его размерность?
13. „то такое мольна€ дол€? акова еЄ размерность?
9. акими соотношени€ми св€заны между собой выражени€ концентрации:
а) массова€ дол€ и мол€рна€ концентраци€;
б) массова€ дол€ и мол€рна€ концентраци€ эквивалента;
в) мол€рна€ концентраци€ и мол€рна€ концентраци€ эквивалента?
¬арианты задач дл€ самосто€тельного решени€
¬ариант є1
1. 5,3 г Na2CO3 растворили в мерной колбе на 100 мл. ѕлотность полученного раствора оказалась равна 1,06 г/мл. –ассчитать:
|
|
|
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. 0,9% раствор NaCl (физраствор) используют в качестве заменител€ плазмы крови. ¬ычислить массу воды, которую надо добавить к 300 г 3% раствора, чтобы получить раствор с w(NaCl) = 0,9%.
3. —ульфат алюмини€ входит в состав лекарств, облегчающих боль и дискомфорт, вызванные укусами насекомых. “ребуетс€ приготовить 200 мл раствора с C( ј12(Sќ4)3) = 0,5 моль/л из 10% раствора плотностью 1,1 г/мл.
ј12(Sќ4)3) = 0,5 моль/л из 10% раствора плотностью 1,1 г/мл.
¬ариант є2
1. 6,4 г CuSO4 растворили в мерной колбе на 100 мл. ѕлотность полученного раствора оказалась равна 1,07 г/мл. –ассчитать:
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. √орькую или английскую соль MgSO4×7H2O примен€ют дл€ снижени€ артериального давлени€. Ќайти массу кристаллогидрата, необходимую дл€ приготовлени€ 250 г 5% раствора MgSO4.
3. 6% раствор HCl используют дл€ лечени€ грибковых заболеваний. “ребуетс€ приготовить 250 мл этого раствора плотностью 1,03 г/мл из раствора с —(HCl) = 6 моль/л.
¬ариант є3
1. 20 г CH3COOH растворили в мерной колбе на 100 мл. ѕлотность раствора оказалась равна 1,025 г/мл. –ассчитать:
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. ѕри ацидозе крови примен€ют 4% раствор гидрокарбоната натри€ (питьевой соды). Ќайти массу воды, которую необходимо прибавить к 250 г 10% раствора NaHCO3, чтобы получить заданный раствор.
3. ѕри отравлени€х используют раствор перманганата кали€ с —(KMnO4) = 0,01 моль/л. “ребуетс€ приготовить 2 л такого раствора из 5% раствора плотностью 1,05 г/мл.
¬ариант є4
1. 1,68 г NaHCO3 растворили в мерной колбе на 100 мл. ѕлотность полученного раствора оказалась равна 1,02 г/мл. –ассчитать:
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. ¬ медицине используют гормональный препарат адреналин. ¬ ампуле объЄмом 1 мл содержитс€ 0,1% раствор плотностью 1 г/мл. Ќайти мол€рную концентрацию этого раствора и массу адреналина в ампуле, если M(адреналин) = 220 г/моль.
3. ѕри гипокалиемии примен€ют инъекции 4% растворов хлорида кали€. “ребуетс€ приготовить 100 мл 4% раствора KCl плотностью 1,05 г/мл из раствора с —(KCl) = 2,5 моль/л.
¬ариант є5
1. 4,44 г CaCl2 растворили в мерной колбе на 100 мл. ѕлотность раствора оказалась равна 1,03 г/мл. –ассчитать:
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. ’лорид цинка используетс€ в медицине в качестве в€жущего и асептического средства. Ќайти максимальный объЄм 5% раствора ZnCl2 плотностью 1,05 г/мл, который можно приготовить из 200 мл 12,5% раствора плотностью 1,1 г/мл.
3. ƒл€ оттока гно€ из ран используют солевые пов€зки, содержащие 5-10% раствор хлорида натри€. Ќайти объЄм раствора с C(NaCl) = 5 моль/л, необходимый дл€ приготовлени€ 250 мл 10% раствора плотностью 1,1 г/мл.
¬ариант є6
1. ƒл€ приготовлени€ нашатырного спирта в 300 мл воды растворили 112 л аммиака (при н. у.). ѕлотность полученного раствора оказалась равна 0,916 г/мл. –ассчитать:
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. √лауберову соль Na2SO4Ј10H2O примен€ют в качестве слабительного средства. Ќайти массу кристаллогидрата, необходимую дл€ приготовлени€ 400 г 10% раствора Na2SO4.
3. ƒл€ восполнени€ жидкости в организме примен€ют 5% раствор глюкозы C6H12O6 плотностью 1,02 г/мл. “ребуетс€ приготовить 500 мл заданного раствора из раствора с —(C6H12O6) = 1,5 моль/л.
|
|
|
¬ариант є7
1. 4,9 г H3PO4 растворили в мерной колбе на 100 мл. ѕлотность полученного раствора оказалась равна 1,04 г/мл. –ассчитать:
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. ƒл€ обеззараживани€ пуповины новорождЄнных используют 5% раствор перманганата кали€ плотностью 1,03 г/мл. Ќайти максимальный объЄм этого раствора, который можно приготовить из навески KMnO4 массой 25 г.
3. ѕри недостаточной кислотности желудочного сока внутрь примен€ют раствор сол€ной кислоты с C(HCl) = 2,5 моль/л. “ребуетс€ приготовить 250 мл этого раствора из 36,5% раствора HCl плотностью 1,18 г/мл.
¬ариант є8
1. 6,84 г ј12(Sќ4)3 растворили в мерной колбе на 100 мл. ѕлотность полученного раствора оказалась равна 1,06 г/мл. –ассчитать:
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. ѕри ожогах щелочами поражЄнный участок кожи промывают водой и затем обрабатывают 3% раствором борной кислоты. Ќайти массу воды, которую необходимо добавить к 150 г 10% раствора H3BO3, чтобы получить требуемый раствор.
3. ƒл€ уничтожени€ личинок чесоточного клеща используют реакцию тиосульфата натри€ с серной кислотой. “ребуетс€ приготовить 4 л раствора с C(H2SO4) = 0,5 моль/л из 15% раствора серной кислоты плотностью 1,1 г/мл.
¬ариант є9
1. 16,25 г FeCl3 растворили в мерной колбе на 100 мл. ѕлотность полученного раствора оказалась равна 1,13 г/мл. –ассчитать:
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. 10% раствор хлорида кальци€ примен€ют в медицине в качестве кровоостанавливающего и противоаллергического средства. ќпределить максимальный объЄм данного раствора плотностью 1,08 г/мл, который можно приготовить из 5 г кристаллогидрата CaCl2Ј6H2O.
3. –ебенку, рождЄнному в состо€нии асфиксии, ввод€т этимизол в расчете 1 мг вещества на 1 кг массы ребенка. ¬ычислить объЄм 1,5% раствора препарата плотностью 1,05 г/мл, который необходимо ввести ребенку массой 3,5 кг.
¬ариант є10
1. 7,1 г Na2HPO4 растворили в мерной колбе на 100 мл. ѕлотность полученного раствора оказалась равна 1,07 г/мл. –ассчитать:
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. ѕри отравлени€х метанолом используют 40% раствор этанола плотностью 0,94 г/мл. “ребуетс€ приготовить 100 мл данного раствора из медицинского спирта с w(C2H5OH) = 96% и плотностью 0,81 г/мл.
3. 5% раствор сульфата меди (II) используют при ожогах кожи фосфором. “ребуетс€ приготовить 200 мл данного раствора плотностью 1,05 г/мл из раствора с —(CuSO4) = 1,35 моль/л.
¬ариант є11
1. 24 г MgSO4 растворили в мерной колбе на 100 мл. ѕлотность полученного раствора оказалась равна 1,2 г/мл. –ассчитать:
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. –астворы щавелевой кислоты используют в клинических лаборатори€х в качестве стандарта. Ќайти массу кристаллогидрата H2C2O4Ј2H2O, необходимую дл€ приготовлени€ 250 мл раствора с
C( H2C2O4) = 0,1 моль/л.
H2C2O4) = 0,1 моль/л.
3. ѕеред пломбированием зубов эмаль и дентин протравливают раствором фосфорной кислоты. “ребуетс€ приготовить 2 л раствора с C(H3PO4) = 0,5 моль/л из 30% раствора плотностью 1,18 г/мл.
¬ариант є12
1. 13,2 г (NH4)2SO4 растворили в мерной колбе на 100 мл. ѕлотность полученного раствора оказалась равна 1,07 г/мл. –ассчитать:
|
|
|
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. ƒл€ обработки ран, порезов, слизистой оболочки используют 3% раствор пероксида водорода. “ребуетс€ приготовить 200 мл 3% раствора H2O2 плотностью 1 г/мл из 30% раствора плотностью 1,1 г/мл.
3. ƒет€м ввод€т но-шпу из расчета 2 мг на 1 кг массы тела. Ќайти объЄм 2% раствора препарата плотностью 1,04 г/мл, который необходимо ввести ребенку массой 25 кг.
¬ариант є13
1. 13,6 г ZnCl2 растворили в мерной колбе на 100 мл. ѕлотность полученного раствора оказалась равна 1,1 г/мл. –ассчитать:
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. ѕациенту требуетс€ ввести 100 мг препарата бемегрид. Ќайти объЄм 0,5% раствора этого препарата плотностью 1 г/мл, содержащий заданную массу препарата.
3. ѕри ожогах кислотами поражЄнный участок кожи промывают водой и затем обрабатывают 4% раствором гидрокарбоната натри€. “ребуетс€ приготовить 500 мл данного раствора плотностью 1,03 г/мл из раствора с —(NaHCO3) = 0,75 моль/л.
¬ариант є14
1. 15,8 г (—H3COO)2Ca растворили в мерной колбе на 100 мл. ѕлотность полученного раствора оказалась равна 1,09 г/мл. –ассчитать:
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. “етраборат натри€ используют как антисептик дл€ полосканий, спринцеваний, обработки кожи и ротовой полости. “ребуетс€ приготовить 500 г 20%-го раствора тетрабората натри€ в глицерине из буры Na2B4O7Ј10H2O.
3. ¬зрослым люд€м ввод€т раствор гидрокарбоната натри€ из расчета 0,66 ммоль на 1 кг массы тела. Ќайти объЄм 4,2%-го раствора NaHCO3 плотностью 1,03 г/мл, который необходимо ввести пациенту массой 76 кг.
¬ариант є15
1. 6,9 г K2CO3 растворили в мерной колбе на 100 мл. ѕлотность полученного раствора оказалась равна 1,06 г/мл. –ассчитать:
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. –аствор сульфата меди (II) с массовой долей 1% и плотностью 1 г/мл €вл€етс€ фармакопейным препаратом и назначаетс€ дл€ улучшени€ кроветворной функции селезЄнки. “ребуетс€ приготовить 1,5 л данного раствора из 10% раствора плотностью 1,12 г/мл.
3. ƒл€ выведени€ пациента из обморочного состо€ни€ примен€ют нашатырный спирт, который представл€ет собой 10% раствор аммиака в воде плотностью 0,96 г/мл. “ребуетс€ приготовить 250 мл нашатырного спирта из раствора аммиака с C(NH3) = 15 моль/л.
¬ариант є16
1. 20 г Fe2(SO4)3 растворили в мерной колбе на 100 мл. ѕлотность полученного раствора оказалась равна 1,15 г/мл. –ассчитать:
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. ѕри алкалозе крови ввод€т 5% раствор аскорбиновой кислоты. “ребуетс€ приготовить 0,5 л данного раствора плотностью 1,08 г/мл из 20% раствора плотностью 1,2 г/мл.
3. ѕри ожогах щелочами поражЄнный участок кожи обрабатывают после промывани€ водой 1%-ным раствором уксусной кислоты плотностью 1 г/мл. “ребуетс€ приготовить 300 мл нашатырного спирта из раствора с C(CH3COOH) = 5 моль/л.
¬ариант є17
1. 8,2 г Na3PO4 растворили в мерной колбе на 100 мл. ѕлотность полученного раствора оказалась равна 1,085 г/мл. –ассчитать:
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. јцетат кали€ оказывает умеренное диуретическое действие. ¬зрослому человеку требуетс€ 10 г препарата в сутки. ”становлено, что оптимальным €вл€етс€ п€тикратный суточный прием. Ќайти объЄм одноразовой дозы препарата, который производ€т в виде 35% раствора плотностью 1,2 г/мл.
3. ƒл€ смазывани€ слизистой оболочки полости рта и горла примен€ют раствор Ћюгол€, который содержит 1 г йода и 3 г йодида кали€ в 17 мл воды, “ребуетс€ приготовить 100 мл раствора Ћюгол€ из раствора с —(KI) = 4,65 моль/л и сухого йода. ѕлотность раствора Ћюгол€ прин€ть равной 1,15 г/мл.
¬ариант є18
1. 9,6 г (NH4)2CO3 растворили в мерной колбе на 100 мл. ѕлотность полученного раствора оказалась равна 1,03 г/мл. –ассчитать:
1) массовую долю;
2) мол€рную концентрацию;
3) мол€рную концентрацию эквивалента;
4) мол€льную концентрацию;
5) титр;
6) мольную долю.
2. ¬ физиологии дл€ изучени€ де€тельности тканей вне органов используют раствор –ингера, который готов€т по прописи: 6,5 г хлорида натри€, 0,42 г хлорида кали€ и 0,25 г хлорида кальци€, растворЄнных в 1 литре бидистиллированной воды. “ребуетс€ приготовить 2,5 л раствора, име€ в распор€жении 2% раствор NaCl, кристаллогидрат CaCl2Ј6H2O и твердый KCl. ѕлотность раствора –ингера считать равной 1 г/мл.
|
|
|
3. ¬ клинических лаборатори€х дл€ определени€ концентрации фосфорной кислоты используют раствор гидроксида натри€ с
C( NaOH) = 0,1 моль/л. “ребуетс€ приготовить 250 мл этого раствора из 4% раствора NaOH плотностью 1,04 г/мл.
NaOH) = 0,1 моль/л. “ребуетс€ приготовить 250 мл этого раствора из 4% раствора NaOH плотностью 1,04 г/мл.
Ћитература
1. ќбща€ хими€. Ѕиофизическа€ хими€. ’ими€ биогенных элементов: учебник дл€ вузов / ё.ј. ≈ршов, ¬.ј. ѕопков, ј.—. Ѕерл€нд; под ред. ё.ј. ≈ршова. 10-е изд., перераб. и доп. ћ.: »зд-во ёрайт, 2014. 560 с.
2. ќбща€ и биоорганическа€ хими€: учеб. дл€ студ. учреждений высш. проф. образовани€ / под ред. ¬.ј. ѕопкова, ј.—. Ѕерл€нда. ћ.: »зд. центр Ђјкадеми€ї, 2010. 368 с.
3. “ермодинамика в физической химии: учеб. дл€ хим. и хим.-технол. спец. вузов / ќ.ћ. ѕолторак. ћ.: ¬ысш. шк. 1991. 319 с.
4. ‘изическа€ хими€. ѕринципы и применение в биологических науках / ». “иноко, . «ауэр, ƒж. ¬энг, ƒж. ѕаглиси; под ред. ¬.». √оршкова. ћ.: “ехносфера, 2005. 744 с.
5. «адачи и вопросы по химии: учеб. пособие дл€ вузов / ќ.—. «айцев. ћ.: ’ими€. 1985. 304 с.
6. —борник задач и упражнений по общей химии: учеб. пособие дл€ бакалавров / —. ј. ѕузаков, ¬. ј. ѕопков, ј. ј. ‘илиппова. 5-е изд., стер. ћ.: »зд-во ёрайт, 2011. 255 с.
7. —борник задач по общей химии / “.Ќ. Ћитвинова. 3-е изд., перераб. ћ.: ќќќ Ђ»здательство Ђќниксї: ќќќ Ђ»здательство Ђћир и образованиеї, 2007. 224 с.
[1] ¬нутренн€€ энерги€ не включает в себ€ кинетическую энергию системы в целом и еЄ потенциальную энергию во внешних пол€х, в частности, гравитационном.
[2] —трого говор€, абсолютно закрытых, или абсолютно изолированных систем в природе не существует. Ёто лишь модельные представлени€, а модель, как известно, всегда беднее феномена.
[3] Ёто требование обусловлено тем, что классическа€ термодинамика лишена возможности Ђзагл€нутьї в ход процесса, так как состо€ние системы €вл€етс€ неравновесным (равновесные процессы - чиста€ абстракци€). лассическа€ термодинамика рассматривает только начальное и конечное состо€ние, промежуточные стадии €вл€ютс€ дл€ неЄ Ђчерным €щикомї.
[4] √овор€т Ђэнтальпи€ реакцииї, всегда име€ в виду DHр-€.
[5] ƒл€ приблизительного расчЄта допустимо прин€ть, что полученный раствор €вл€етс€ сильно разбавленным, и некоторые его свойства близки к свойствам воды: r (р-р)ї 1 кг/л, m (р-р)ї 0,05 кг, Cї 4,2 кƒж/(кг× ).
[6] ќписанные ситуации имеют софистическую заострЄнность, но сам вопрос закономерен.
[7] Ѕыло бы заманчиво охладить “ихий океан хот€ бы на 0,50, полученной энергии нашлось бы применение.
[8] при отсутствии метаболизма.
[9] при равных исходных концентраци€х реагирующих веществ.
[10] от греч. pharmakon - лекарство и kinetikos - привод€щий в движение
[11] Ќе следует путать фармакокинетику с фармакодинамикой - наукой о действии лекарственного препарата на организм.
[12] Ќеобратимые реакции также могут описыватьс€ через состо€ние химического равновеси€, но в этом нет никакого практического интереса.
[13] ќднако при этом не следует отождествл€ть термодинамическую обратимость и химическую. Ќапомним, что термодинамически обратимым €вл€етс€ процесс, который можно провести в обратном направлении без дополнительных энергозатрат. ’имически обратимый процесс может протекать в обратном направлении только при изменении внешних условий: температуры, давлени€, концентрации реагентов и т. д. —оответственно, к химически необратимым процессам относ€т те, которые невозможно повернуть назад в реальных услови€х.
[14] ‘ормулы приведены при равных исходных концентраци€х реагирующих веществ.






