Ознакомьтесь с теорией в конспекте и учебнике (Савельев, т.3, §12, §28). Запустите программу «Эл-магн.Кванты». Выберите «Квантовая физика», «Постулаты Бора». Нажмите вверху внутреннего окна кнопку с изображением страницы. Прочитайте краткие теоретические сведения. Необходимое запишите в свой конспект. (Если вы забыли, как работать с системой компьютерного моделирования, прочитайте ВВЕДЕНИЕ стр.5 еще раз).
ЦЕЛЬ РАБОТЫ:
* Знакомство с планетарной и квантовой моделями атома при моделировании процесса испускания электромагнитного излучения возбужденными атомами водорода.
* Экспериментальное подтверждение закономерностей формирования линейчатого спектра излучения атомарного водорода при низких давлениях.
* Экспериментальное определение постоянной Ридберга.
КРАТКАЯ ТЕОРИЯ:
СПЕКТРОМ электромагнитного излучения (ЭМИ) называется совокупность электромагнитных волн, излучаемых или поглощаемых атомами (молекулами) данного вещества.
ЛИНЕЙЧАТЫЙ спектр состоит из отдельных компонент (линий), близких к гармоническим. Расстояние между линиями (по шкале длин волн или частот) много больше ширины линий. Такой спектр излучают атомарные газы.
Кроме линейчатого выделяют еще ПОЛОСАТЫЙ спектр, который излучают молекулярные газы и СПЛОШНОЙ спектр, излучаемый нагретыми твердыми телами.
ПЛАНЕТАРНАЯ МОДЕЛЬ атома: в центре атома расположено очень малое положительно заряженное ядро, вокруг которого по определенным (разрешенным) стационарным орбитам движутся электроны, масса которых во много раз меньше массы ядра. При движении по орбите электрон не испускает электромагнитного излучения (ЭМИ). При поглощении ЭМИ (фотона) электрон переходит на более «высокую» разрешенную орбиту, на которой его энергия становится больше на величину DЕЭЛ, равную энергии поглощенного фотона ЕФ. При обратном переходе электрон испускает фотон с такой же энергии ЕФ = |DЕЭЛ |.
КВАНТОВАЯ модель атома отличается от планетарной в первую очередь тем, что в ней электрон не имеет точно определенной координаты и скорости, поэтому бессмысленно говорить о траектории его движения. Можно определить (и нарисовать) только границы области его преимущественного движения (орбитали).
УРАВНЕНИЕ ШРЕДИНГЕРА для движения электрона в кулоновском поле ядра атома водорода используется для анализа квантовой модели атома. В результате решения этого уравнения получается волновая функция, которая зависит не только от координаты 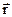 и времени t, но и от 4-х параметров, имеющих дискретный набор значений и называемых квантовыми числами. Они имеют названия: главное, азимутальное, магнитное и магнитное спиновое.
и времени t, но и от 4-х параметров, имеющих дискретный набор значений и называемых квантовыми числами. Они имеют названия: главное, азимутальное, магнитное и магнитное спиновое.
Главное квантовое число n может принимать целочисленные значения 1, 2,.... Оно определяет величину энергии электрона в атоме
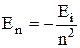 , где Еi - энергия ионизации атома водорода (13.6 эВ).
, где Еi - энергия ионизации атома водорода (13.6 эВ).
АЗИМУТАЛЬНОЕ (ОРБИТАЛЬНОЕ) квантовое число l определяет модуль моментаимпульса электрона при его орбитальном движении  . Оно принимает целочисленные значения l = 0, 1, 2,... n-1.
. Оно принимает целочисленные значения l = 0, 1, 2,... n-1.
МАГНИТНОЕ квантовое число ml определяет проекцию вектора момента импульса орбитального движения электрона LZ на направление внешнего магнитного поля  . Оно принимает положительные и отрицательные целочисленные значения, по модулю меньшие или равные l.
. Оно принимает положительные и отрицательные целочисленные значения, по модулю меньшие или равные l. 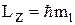 , где ml = 0, ±1, ±2,..., ± l.
, где ml = 0, ±1, ±2,..., ± l.
МАГНИТНОЕ спиновое квантовое число mS определяет проекцию вектора собственного момента импульса электрона (СПИНА 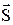 ) на направление внешнего магнитного поля
) на направление внешнего магнитного поля  :
:
SZ =  mS и принимает только 2 значения: mS = +1/2, -1/2. Для модуля спина
mS и принимает только 2 значения: mS = +1/2, -1/2. Для модуля спина  , где s – спиновое квантовое число, которое у каждой частицы имеет только одно значение. Например, для электрона s =
, где s – спиновое квантовое число, которое у каждой частицы имеет только одно значение. Например, для электрона s =  (аналогично, для протона и нейтрона). Для фотона s = 1.
(аналогично, для протона и нейтрона). Для фотона s = 1.
ВЫРОЖДЕННЫМИ называются состояния электрона с одинаковой энергией.
КРАТНОСТЬ ВЫРОЖДЕНИЯ равна количеству состояний с одной и той же энергией.
КРАТКАЯ запись состояния электрона в атоме: ЦИФРА, равная главному квантовому числу, и буква, определяющая азимутальное квантовое число:
| Буква | s | p | d | e | f |
| Значение l |
ПРАВИЛО ОТБОРА азимутального квантового числа D l = ±1. Электрон в атоме может переходить только между состояниями, удовлетворяющему указанному правилу.
СПЕКТРАЛЬНОЙ СЕРИЕЙ называется совокупность линий излучения, соответствующих переходу электрона в атоме на один и тот же нижний уровень энергии:
| Серия | Лаймана | Бальмера | Пашена | Брэкета |
| Переходы | np®1s | ns®2p, nd®2p | nf®3d, np®3d | ng®4f, nd®4f |






